1、填空题 (6分)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,
已知:As是产物之一。
(1)写出并配平该反应的化学方程式 ______________?
(2)在反应中,每转移1 mol电子,消耗(或生成)HCl_______mol;
(3)下列叙述正确的是_____________(填写序号)。
a.在相同条件下,第VIIA族元素的阴离子的还原性从上到下逐渐增强
b.Sn和Pb位于同一主族,其+4价的化合物均很稳定
c.在相同条件下,还原性顺序:S2->I->Fe2+>Br->Cl-
d.在上述反应中,氧化性:SnCl2?>As,还原性:H3AsO3>H2SnCl6
2、选择题 下列反应不属于氧化还原反应的是
[? ]
A.Al(OH)3+3HCl==AlCl3+3H2O
B.3Fe+4H2O(g)=Fe3O4+4H2
C.3NO2+H2O==2HNO3+NO
D.Cl2+H2O==HCl+HClO
3、填空题 (1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性,含VO2+、K+、SO42-等。写出该反应的化学方程式_________________________________。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl-。写出并配平该反应的离子方程式,并标出电子转移的数目和方向______________________。
(3)在20.00 mL的0.1 mol·L-1 VO2+溶液中,加入0.195 g锌粉,恰好完成反应,则还原产物可能是______________________________________________________________。
a.V? b.V2+? c.VO2+? d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32->Cl->VO2+__________________________________。
4、选择题 钛被誉为“21世纪金属”。工业冶炼钛的第一步反应为:
TiO2+2C+2Cl2?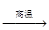 ?TiCl4+2CO。下列关于该反应的说法正确的是
?TiCl4+2CO。下列关于该反应的说法正确的是
A.TiO2是氧化剂
B.氧化剂与还原剂的物质的量之比为1:1
C.Cl2发生氧化反应
D.当2 mol C参加反应时,转移的电子数目为2 mol
5、选择题 下表列举的各组陈述中存在因果关系的是
编号
| 陈述I(原因)
| 陈述II(结果)
|
A
| O3能吸收紫外线
| 高空中得O3层被称为地球的保护伞
|
B
| 向100ml0.1mol/L的AlCl3溶液中加入1.5g NaOH发生反应
| Al(OH)3会完全溶解
|
C
| 钠原子核外电子数比铝少
| 钠的金属性比铝强
|
D
| HClO和SO2都具有漂白性
| 将Cl2和SO2同时 通入品红溶液,品红褪色会更快 通入品红溶液,品红褪色会更快
|