1、填空题 I、镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用?,要使MgSO4完全转化为
沉淀,加入试剂的量应为?。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是?。
(3)试剂②选用?;写出其反应的离子方程式?。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为?。
Ⅱ.关于《必修2》中提到的常见有机物,请回答下列问题:
(1)苯在常温常压下呈?态。
(2)常温常压下气态直链烷烃含碳原子数≤??。
(3)苯和甲烷中含碳量较高的是?。
(4) 写出苯与浓硝酸、浓硫酸混合液加热反应的化学方程式(用结构简式书写)?。
(5) 写出乙醇和乙酸的酯化反应方程式 ??。
参考答案:(每空2分,共22分)I、 (1)氢氧化钙或生石灰,过量? (2)过滤
(3)盐酸;2 H+ + Mg(OH)2=2H2O + Mg2+?(4) MgCl2(熔融) Mg + Cl2↑
Mg + Cl2↑
II.(1)液(2)4 (3)苯 (4) 
(5) CH3COOH+CH3CH2OH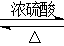 ?CH3COOCH2CH3 +H2O
?CH3COOCH2CH3 +H2O
本题解析:I、(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用廉价的氢氧化钙或生石灰。要使MgSO4完全转化为沉淀,加入试剂的量应为过量的。
(2)氢氧化镁不溶于水,分离得到Mg(OH)2沉淀的方法是过滤。
(3)氢氧化镁转化为氯化镁应该用盐酸,反应的离子方程式是2H+ + Mg(OH)2=2H2O + Mg2+ 。
?(4)镁是活泼的金属,应该用电解法冶炼,反应的化学方程式是 MgCl2(熔融) Mg + Cl2↑。
Mg + Cl2↑。
Ⅱ. (1)苯在常温常压下呈液态。
(2)常温常压下气态直链烷烃含碳原子数≤4,即甲烷、乙烷、丙烷和丁烷。
(3)苯和甲烷中含碳量较高的是甲苯,甲烷是含氢量最高的烃。
(4)苯与浓硝酸、浓硫酸混合液加热发生取代反应生成硝基苯,反应的化学方程式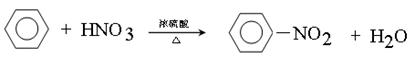 。
。
(5)乙醇和乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式是CH3COOH+CH3CH2OH ?CH3COOCH2CH3 +H2O。
?CH3COOCH2CH3 +H2O。
点评:该题紧扣教材基础知识,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于提高学生的应试能力,也有助于培养学生的规范答题能力,难度不大,记住并熟练应用即可。
本题难度:一般
2、填空题 普通玻璃的主要成分有_________、__________和__________,水泥的主要特性是____________。
参考答案:Na2SiO3;CaSiO3;SiO2;水硬性
本题解析:
本题难度:一般
3、填空题 石棉是一类建筑材料,主要成分为硅酸盐,有毒,化学式是Na2Fe5Si8O22(OH)2.
(1)该石棉中与5个铁原子形成氧化物的氧原子数是______个.
(2)化学式中铁元素的化合价为______.
(3)这种石棉的化学式改写成氧化物形式为______.
(4)该石棉与酸或碱反应时可以看作各氧化物分别与酸、碱反应,则该石棉与足量的稀硝酸反应后过滤,滤渣主要是______.
参考答案:(1)根据硅酸盐以氧化物的形式来表示化学式的方法:先写活泼金属氧化物,然后是次活泼金属氧化物,再然后是二氧化硅,最后是水(原子数要守恒),所以石棉的化学式改写成氧化物形式为Na2O?Fe2O3?3FeO?8SiO2?H2O,与5个铁原子形成氧化物的氧原子数是6个,故答案为:6;
(2)根据石棉氧化物形式的化学式得到铁元素的化合价为+2、+3,故答案为:+2、+3;
(3)石棉的化学式改写成氧化物形式为Na2O?Fe2O3?3FeO?8SiO2?H2O,故答案为:Na2O?Fe2O3?3FeO?8SiO2?H2O;
(4)Na2O、Fe2O3、FeO均能和足量的稀硝酸反应,生成溶液,只有SiO2和硝酸不反应,过滤后成为滤渣,故答案为:SiO2;
本题解析:
本题难度:一般
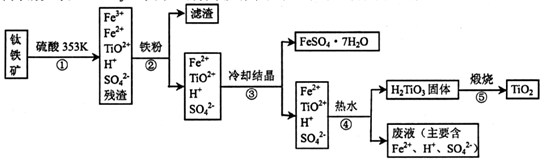
4、填空题 工业上,以钛铁矿为原料制备二氧化钛的某工艺流程如下图所示。钛铁矿主要成分
为钛酸亚铁( FeTiO3).其中一部分铁元素在风化过程中会转化为+3价。
完成下列填空:
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为____。
(2)步骤③中,实现混合物的分离是利用物质的____(填字母序号)。
a.熔沸点差异? b溶解性差异? c氧化性、还原性差异
(3)步骤②、③、④中,均需进行的操作是____(填操作名称)。
(4)可利用生产过程中的废液与软锰矿(主要成分MnO2)反应生产硫酸锰,则反应的离子方程式为?
(5)利用下图装置,石墨作阳极,钛网作阴极,熔融CaF2-CaO做电解质,可获得金属钙,钙再作为还原剂,可还原二氧化钛制各金属钛。
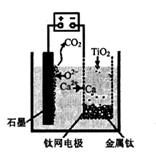
①阳极所发生的反应为________。
②在制备金属钛前后,CaO的总量不变,其原因是____。
(6)_T业上用4.0吨钛铁矿制得1. 6吨的二氧化钛,则钛铁矿中钛元素的质量分数是____。
(假设生产过程中钛没有损失)
参考答案:
(1) 2Fe3++Fe=3Fe2+? (2分)?(2) b? (2分)?(3) 过滤? (2分)
(4) MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O? (2分)
(5)① 2O2-—4e-+C=CO2↑? (2分)?
② 制备TiO2时,电解槽发生反应:2CaO 2Ca+O2↑,2Ca+ TiO2="Ti" +2CaO,可知CaO的总量不会变(3分)?(合理答案给分)
2Ca+O2↑,2Ca+ TiO2="Ti" +2CaO,可知CaO的总量不会变(3分)?(合理答案给分)
(6) 24%? (2分)
本题解析:(1)见答案(2)将FeSO4·7H2O从溶液中分离出来,利用了物质溶解性的差异(3)步骤②、③、④均是固液分离(4)废液中含有H+和Fe2+具有还原性,与MnO2发生氧化还原反应(5)由图可知,O2-在阳极放电,石墨电极参与反应生成了CO2
(6)Ti?~? TiO2
48? 80
m= 0.96t? 1.6t
则钛铁矿中钛元素的质量分数是0.96÷4.0×100%=24%
本题难度:一般
5、选择题 为应对石油危机,2006年1月1日,我省“苏北五市”决定全面推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。下列有关说法正确的是
A.乙醇汽油是一种清洁能源,燃烧不会产生污染
B.乙醇与汽油组成元素相同,化学成分相似
C.乙醇汽油燃烧时,耗氧量高于等质量的汽油
D.乙醇可通过淀粉转化制得,是一种可再生的燃料
参考答案:D
本题解析:略
本题难度:简单