1、选择题 用括号内的试剂和分离方法,除去下列物质中的少量杂质,正确的是
A.乙醇中的乙酸(碱石灰,蒸馏)
B.乙烷中的乙烯(NaOH溶液,洗气)
C.溴苯中的溴(KI溶液,分液)
D.乙酸乙酯中的乙酸(饱和NaOH溶液,过滤)
参考答案:A
本题解析:A正确,碱石灰可与乙酸反应生成难挥发的盐,同时放热便于乙醇的挥发;
B错,乙烯不与NaOH溶液反应,可用溴水除去;C错,溴苯中的溴可用NaOH溶液处理;D错,乙酸乙酯中的乙酸用饱和的碳酸钠溶液处理;
本题难度:一般
2、选择题 下列各组物质中,可以将碘水中的碘萃取出来的是( )
A.水
B.四氯化碳
C.酒精
D.都不可以
参考答案:B
本题解析:
本题难度:一般
3、填空题 海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。

完成下列填空:
(1)氯碱工业主要以食盐为原料。为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作,正确的操作顺序是?。
①过滤;②加过量的NaOH溶液;③加适量的盐酸;④加过量的Na2CO3溶液;⑤加过量的BaCl2溶液
a.②⑤④①③? b.①④②⑤③? c? d.⑤②④①③
(2)在实验室中可以用萃取的方法提取溴,可选用的试剂是________________,所用主要仪器的名称是____________________。
(3)步骤Ⅰ中用硫酸酸化可提高Cl2利用率的原因是?。
(4)步骤II反应的离子方程式__________________________________________。
(5)海水提溴蒸馏过程中,温度应控制在80~90℃,温度过高或过低都不利于生产 ,请解释原因?。
(6)Mg(OH)2沉淀中混有Ca(OH)2,可选用__________溶液进行洗涤除去。如直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,你_______(选填“同意”,“不同意”)该说法,理由是?。
参考答案:(1)AD
(2)CCl4(或苯);分液漏斗
(3)酸化可抑制Cl2 、Br2与水反应
(4)Br2+SO2+2H2O→4H++SO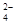 +2Br—(2分)
+2Br—(2分)
(5)温度过高,大量水蒸气随水排除出,溴蒸气中水增加;温度过低,溴不能完全蒸出,吸收率低。(2分)
(6)MgCl2。不同意;MgO熔点很高,熔融时耗能高,增加生产成本。(2分)
本题解析:(1)除杂时为了把杂质除净除杂试剂需过量,除去粗盐中的Ca2+、Mg2+、SO42-分别选用Na2CO3溶液、NaOH溶液、?BaCl2溶液,前两中试剂可以用适量的盐酸除去,?BaCl2溶液只能放在加入Na2CO3溶液步骤前面,用其除去,注意加盐酸前过滤除去沉淀,故操作顺序为②⑤④①③?或⑤②④①③;
(2)萃取试剂不能与水互溶且被提取的物质在试剂中的溶解度要远大于在水中的溶解度,实验在分液漏斗中进行;
(3)Cl2 、Br2与水反应是可逆反应,酸化可抑制Cl2 、Br2与水反应;
(5)温度过高,大量水蒸气随水排除出,溴蒸气中水增加;温度过低,溴不能完全蒸出,吸收率低。
(6)选用MgCl2溶液,使Ca(OH)2转化为Mg(OH)2,同时洗去杂质;MgO熔点很高,熔融时耗能高,增加生产成本,故不用电解熔融MgO制金属镁。
本题难度:一般
4、选择题 下列出去杂质的方法正确的是( )
A.除去CO2中混有的CO:用澄清的石灰水洗气
B.除去NaHCO3溶液中混有的Na2CO3:通入足量的二氧化碳
C.除去FeCl3溶液中混有的CuCl2:加入过量的铁粉过滤
D.除去BaCO3固体中混有的BaSO4:加入过量的盐酸、过滤、洗涤
参考答案:B
本题解析:
本题难度:一般
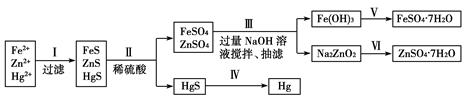
5、填空题 某工厂排出的污水中含有大量的Fe2+、Zn2+、Hg2+三种金属离子。以下是某化学研究性学习小组的同学设计的除去污水中的金属离子,回收绿矾、皓矾(ZnSO4·7H2O)和汞的方案。
[药品] NaOH溶液、硫化钠溶液、硫化亚铁、稀硫酸、铁粉
[实验方案]
[问题探究]
(1)步骤Ⅱ所发生反应的离子方程式为_________________________________________________。
(2)步骤Ⅲ中的抽滤为减压条件下的过滤,可以加快过滤速度;该步骤涉及反应的离子方程式有Zn2++4OH-=ZnO22-+2H2O和________________。
(3)步骤Ⅵ中得到硫酸锌溶液的离子反应方程式为______________________________。
(4)欲实现步骤Ⅴ,所需加入的试剂有________、________,所涉及的主要操作依次为______________________。
(5)步骤Ⅳ常用的方法是加热,该步骤是否对环境有影响?__________(填“是”或“否”),如有影响,请你设计一个环境保护方案来实现步骤Ⅳ的反应________________________。
参考答案:(1)FeS+2H+=Fe2++H2S↑,ZnS+2H+=Zn2++H2S↑
(2)4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓
(3)ZnO22-+4H+=Zn2++2H2O
(4)稀硫酸 铁粉 过滤、浓缩结晶、过滤
(5) 是 在密闭容器中加热HgS
本题解析:(1)步骤Ⅱ加入稀硫酸,与FeS、ZnS分别发生复分解反应,可写成离子方程式。
(2)FeSO4、ZnSO4混合溶液中加入过量的NaOH时,Fe2+与OH-反应生成Fe(OH)2,Fe(OH)2迅速被空气中的O2氧化为Fe(OH)3,其总反应的离子方程式为:4Fe2++O2+8OH-+2H2O=4Fe(OH)3↓。
(3)根据框图转化关系,可以看出Zn(OH)2的性质类似于Al(OH)3,所以Na2ZnO2溶液中加入过量的H2SO4生成ZnSO4溶液,其离子方程式为:ZnO22-+4H+=Zn2++2H2O。
(4)氢氧化铁能与稀硫酸反应生成硫酸铁,硫酸铁能与过量铁单质反应生成二价铁离子,然后过滤、浓缩结晶、过滤得到FeSO4?7H2O。
(5)HgS在空气中加热可得Hg、SO2,Hg蒸气和SO2都会对环境产生污染,但在密闭容器中加热HgS可有效防止Hg蒸气和SO2释放到大气中,从而保护了环境。
本题难度:一般