1、填空题 (21分)I:(9分)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据,回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为__________ 。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。可供选用的仪器有:①胶头滴管;②玻璃棒;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
①配制稀盐酸时,还缺少的仪器有 (写仪器名称);该仪器上标有以下五项中的 ;
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②该学生需要量取________mL上述浓盐酸进行配制。
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面。( )
b.量筒量取浓盐酸后有用蒸馏水洗涤2~3次,并将洗液移入容量瓶中。( )
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
II:(12分)某溶液中有K+、Cl-、CO32-、SO42-,今要求只取一次溶液先后检验出CO32-、SO42-、Cl-,请你帮助小明同学完成下列实验设计:
(1)试剂:先加__________,依据现象__________,确定CO32-离子存在;再加__________,再依据现象____________,确定SO42-离子存在;取上层溶液,最后加____________,依据现象____________,确定Cl-离子存在。
(2)根据你选择的试剂,写出检验CO32-、SO42-、Cl-的离子方程式:
①_________________________________;②_________________________________;
③_________________________________。
参考答案:(1)11.9mol/L;(2)BD;(3)①500mL容量瓶;ACE,②16.8;③a.B;b.A;(4)①25 ②C;
II:(1)过量硝酸,产生无色无味的气体;过量Ba(NO3)2溶液,产生白色沉淀;AgNO3,产生白色沉淀
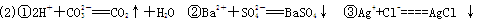
本题解析:(1)如图所示,盐酸的浓度为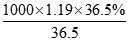 =11.9mol/L;(2)A.溶液中HCl的物质的量=nV,所以与溶液的体积有关,故A不选;B.溶液的浓度与溶液的体积无关,故B选;C.溶液中Cl-的数目=nNA=CVNA,所以与溶液的体积有关,故c不选;D.溶液的密度与溶液的体积无关,故D选;答案选BD;(3)①用浓溶液配置稀溶液需要的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,要配置500ml溶液应选择500ml的容量瓶,容量瓶上标有容积、刻度线、温度.故答案为:500ml容量瓶;ACE;②溶液稀释前后溶质的物质的量保持不变,设需要浓盐酸的体积V,则11.9mol/L×V=0.400mol/L×500ml,解得V=16.8ml;故答案为:16.8;③用量筒量取浓盐酸时俯视观察凹液面,量取浓盐酸的体积偏小,导致溶质的物质的量n偏小,溶液浓度偏小;量筒中的洗涤液不需转移到容量瓶中,若转移到容量瓶中,是溶质的物质的量偏大,浓度偏大,故答案为:a. B;b.A ;(4)①n(HC l)=n(NaOH)=0.01mol,V(HCl)=
=11.9mol/L;(2)A.溶液中HCl的物质的量=nV,所以与溶液的体积有关,故A不选;B.溶液的浓度与溶液的体积无关,故B选;C.溶液中Cl-的数目=nNA=CVNA,所以与溶液的体积有关,故c不选;D.溶液的密度与溶液的体积无关,故D选;答案选BD;(3)①用浓溶液配置稀溶液需要的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,要配置500ml溶液应选择500ml的容量瓶,容量瓶上标有容积、刻度线、温度.故答案为:500ml容量瓶;ACE;②溶液稀释前后溶质的物质的量保持不变,设需要浓盐酸的体积V,则11.9mol/L×V=0.400mol/L×500ml,解得V=16.8ml;故答案为:16.8;③用量筒量取浓盐酸时俯视观察凹液面,量取浓盐酸的体积偏小,导致溶质的物质的量n偏小,溶液浓度偏小;量筒中的洗涤液不需转移到容量瓶中,若转移到容量瓶中,是溶质的物质的量偏大,浓度偏大,故答案为:a. B;b.A ;(4)①n(HC l)=n(NaOH)=0.01mol,V(HCl)=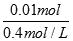 =0.025L=25mL,故答案为:25;②消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了,A、浓盐酸挥发,浓度不足,配制的标准液浓度减小,滴定时消耗盐酸体积变大,故A不选;B、配制溶液时,未洗涤烧杯,标准液浓度减小,消耗体积增大,故B不选;C、配制溶液时,俯视容量瓶刻度线,配制的标准液浓度变大,滴定时消耗的体积减小,故C选;D、加水时超过刻度线,用胶头滴管吸出,标准液浓度减小,滴定时消耗标准液体积增大,故D不选;答案为①25 ②C;II:(1)Cl-、CO32-、SO42-,分别用硝酸银、氢离子、钡离子检验,而硝酸银遇到碳酸根离子与硫酸根离子均产生沉淀,故最后检验氯离子,答案为:过量硝酸,产生无色无味的气体;过量Ba(NO3)2溶液,产生白色沉淀;AgNO3,产生白色沉淀。
=0.025L=25mL,故答案为:25;②消耗的标准液盐酸体积减少,说明读数时标准液的体积比实际体积减少了,A、浓盐酸挥发,浓度不足,配制的标准液浓度减小,滴定时消耗盐酸体积变大,故A不选;B、配制溶液时,未洗涤烧杯,标准液浓度减小,消耗体积增大,故B不选;C、配制溶液时,俯视容量瓶刻度线,配制的标准液浓度变大,滴定时消耗的体积减小,故C选;D、加水时超过刻度线,用胶头滴管吸出,标准液浓度减小,滴定时消耗标准液体积增大,故D不选;答案为①25 ②C;II:(1)Cl-、CO32-、SO42-,分别用硝酸银、氢离子、钡离子检验,而硝酸银遇到碳酸根离子与硫酸根离子均产生沉淀,故最后检验氯离子,答案为:过量硝酸,产生无色无味的气体;过量Ba(NO3)2溶液,产生白色沉淀;AgNO3,产生白色沉淀。
考点:离子检验、容量瓶的使用
本题难度:一般
2、选择题 ClO2遇浓盐酸会生成Cl2 ,反应方程式为2ClO2?+ 8HCl = 5Cl2 + 4H2O ,该反应中若转移电子的数目为9.632×1023,则产生的Cl2在标况下的体积为
A.11.2L
B.33.6L
C.22.4L
D.44.8L
参考答案:C
本题解析:反应中转移电子的物质的量是9.632×1023÷6.02×1023/mol=1.6mol。根据反应的方程式可知,每生成5mol氯气,反应中就转移8mol电子,所以该反应中生成的氯气是1mol,标准状况下的体积是22.4L,答案选C。
本题难度:一般
3、选择题 100mL 0.1mol·L-1的碳酸钠溶液所含碳酸钠的质量是
A.10.6g
B.1.06g
C.0.53g
D.106g