1、简答题 如图中A∽E均为中学化学中常见的物质,它们之间有如下转化关系.其中A、D为金属单质.C是两性氧化物,B为红棕色粉末(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)B是______,C是______.(填化学式)
(2)写出E与NaOH溶液反应的实验现象______.
(3)A在常温下也可与NaOH溶液反应,写出此反应的化学方程式______.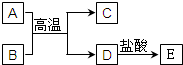
参考答案:C是两性氧化物,应为Al2O3,B为红棕色粉末,应为Fe2O3,则A和B的反应为铝热反应,A为Al,D为Fe,则E为FeCl2,
(1)由以上分析可知,B为Fe2O3,C为Al2O3,故答案为:Fe2O3;Al2O3;
(2)为FeCl2,加入NaOH溶液,生成Fe(OH)2,为白色沉淀,Fe(OH)2不稳定,易被氧化为红褐色Fe(OH)3,现象为产生白色沉淀,迅速变成灰绿色,最终变成红褐色,
故答案为:产生白色沉淀,迅速变成灰绿色,最终变成红褐色;
(3)A为Al,可与NaOH反应生成氢气,反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.
本题解析:
本题难度:一般
2、简答题 A、B、C、D、E五种化合物均含有某种常见短周期元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)
(1)写出化学式:A______,B______,C______,D______,E______.
(2)写出下列反应的离子方程式:A→B:______;A→D______.
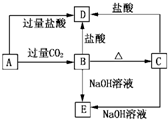
参考答案:B、C都既能与盐酸反应又能与NaOH溶液反应,应为两性化合物,因B加热分解可生成C,则可知B为Al(OH)3,C为A12O3,则D为AlCl3,E为NaAlO2,若取A溶液灼烧,焰色反应为紫色(透过蓝色钴玻璃片),说明A中含有K元素,A能与二氧化碳反应生成Al(OH)3,则A应为KAlO2,
(1)通过以上分析知,A、B、C、D、E分别是KAlO2、Al(OH)3、A12O3、AlCl3、NaAlO2,
故答案为:KAlO2;Al(OH)3;A12O3;AlCl3;NaAlO2;
(2)A→B的反应为AlO2-和Al(OH)3的转化,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,
A→D的反应为AlO2-和Al3+的转化,反应的离子方程式为AlO2-+4H+=Al3++2H2O,
故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;AlO2-+4H+=Al3++2H2O.
本题解析:
本题难度:简单
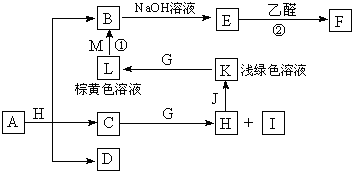
3、简答题 各物质之间的转化关系如图,部分生成物省略.C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10.D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板.
据此回答下列各题:
(1)写出纯净物A的化学式______,C的电子式______,用来检验L中阳离子的试剂是______(该试剂焰色为紫色).
(2)沉淀E可溶于过量______(填试剂名称)得到深蓝色的透明溶液,呈现该颜色是因为溶液中存在配离子______(填化学式).
(3)写出反应①的离子方程式______,写出反应②的化学方程式(有机物用结构简式表示)______.
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体,请写出该反应的化学方程式______.
参考答案:X在周期表中的原子半径最小,为H元素,Y、Z原子最外层电子数之和为10,“X、Y、Z的原子序数依次增大”,进而推出D(由H、C、O中的两种元素组成;无色非可燃性气体)为CO2,可以知道X、Y、Z是H、C、O,则C为H2O,H为HCl,I有漂白作用,应为HClO,浅绿色、棕黄色溶液为Fe2+和Fe3+,可知J为Fe,K为FeCl2,L为FeCl3,反应①用于制作印刷电路板为FeCl3和Cu,则M为Cu,B为CuCl2,E能与乙醛反应,应为Cu(OH)2,F为Cu2O,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,从A+H(HCl)=B(CuCl2)+C(H2O)+D(CO2)可知,A是含有Cu2+的碳酸盐,应为CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3,
(1)由以上分析可知A是CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3,C为H2O,电子式为
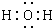
,L为FeCl3,用来检验L中阳离子的试剂是硫氰化钾,
故答案为:CuCO3或Cu2(OH)2CO3或Cu(OH)2?CuCO3;
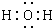
;硫氰化钾;
(2)E为Cu(OH)2,可与氨水发生络合反应生成[Cu(NH3)4]2+,得到深蓝色的透明溶液,
故答案为:氨水;[Cu(NH3)4]2+;
(3)反应①为氯化铁和铜的反应,反应的离子方程式为Cu+2Fe3+═Cu2++2Fe2+,乙醛和氢氧化铜浊液在加热的条件下反应的方程式为CH3CHO+2Cu(OH)2+NaOH△
本题解析:
本题难度:一般
4、填空题 (9分)以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学课本中介绍的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。
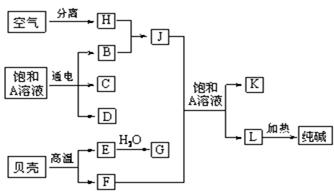
(1) C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式:?。
(2) 电解A溶液反应的离子方程式为___________________________。
若该反应中转移电子数为8NA,则产生的氯气在标准状况下体积为?L
(3) J分子的空间构型为______________________
(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:_______________________________________。
参考答案:(9分)(1)2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2?+ 2H2O? (2分)
(2)2H2O+2Cl-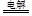 Cl2↑+H2↑+2OH-?89.6L?(4分)
Cl2↑+H2↑+2OH-?89.6L?(4分)
(3) 三角锥 ? (1分)
(4) Ca(OH)2+2NH4Cl 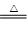 ?CaCl2+2NH3↑+2H2O? (2分)
?CaCl2+2NH3↑+2H2O? (2分)
本题解析:本题是无机框图题,关键是找准突破点。贝壳的主要成分是碳酸钙,高温下分解生成氧化钙和CO2。由于海水中含有氯化钠,且 C和D、C和G反应都可以制取消毒剂,这说明C是氯气,D是氢氧化钠,B是氢气,而A是氯化钠。J与CO2通入饱和氯化钠溶液中能得到L,而L加热即生成碳酸钠,说明L是碳酸氢钠,因此该反应式侯氏制碱法的原理,即J是氨气,则H是氮气,K是氯化铵。
(1)氯气和氢氧化钙反应生成漂白粉的方程式是2Cl2 + 2Ca(OH)2 === CaCl2 + Ca(ClO)2?+ 2H2O。
(2)工业电解饱和食盐水的方程式是2H2O+2Cl- Cl2↑+H2↑+2OH-。关键方程式可知,反应中转移2个电子,所以如果转移8NA个电子,则生成氢气和氯气各是4mol,在标准状况下的体积是4mol×22.4L/mol=89.6L。
Cl2↑+H2↑+2OH-。关键方程式可知,反应中转移2个电子,所以如果转移8NA个电子,则生成氢气和氯气各是4mol,在标准状况下的体积是4mol×22.4L/mol=89.6L。
(3)氨气是三角锥形结构。
(4)实验室制取氨气的方程式是Ca(OH)2+2NH4Cl  ?CaCl2+2NH3↑+2H2O。
?CaCl2+2NH3↑+2H2O。
本题难度:一般
5、简答题 A、B、C、D、E为中学化学常见物质,其中A、C为金属单质,E为非金属单质,下图是它们之间的相互转化关系.请回答:
(1)反应①的基本反应类型是______;
(2)C的化学式为______;
(3)写出物质E和B在加热条件下反应的化学方?程式______;
(4)将浅绿色溶液D转化为黄色溶液的方法是(用离子方程式表示)______.
(5)乙醇在A作催化剂的条件下可以被空气中的氧气催化氧化,试写出该反应的化学方程式:______.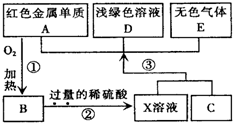
参考答案:由A为红色金属单质,则A为Cu,由反应①可知B为CuO,由反应②X为硫酸铜、硫酸混合溶液,由反应③X溶液+C→A+D+E,且D为浅绿色溶液(含有Fe2+),E为无色气体,故C为Fe,D为FeSO4,E为H2,
(1)反应①是2Cu+O2?点燃?.?2CuO,属于化合反应,故答案为:化合反应;
(2)由上述分析可知,C为Fe,故答案为:Fe;
(3)H2和CuO在加热条件下反应是Cu与H2O,反应方程式为:H2+CuO?△?.?Cu+H2O,故答案为:H2+CuO?△?.?Cu+H2O;
(4)利用强氧化剂将浅绿色FeSO4溶液转化为黄色Fe2(SO4)3溶液,如加入氯水等,反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;
(5)乙醇在Cu作催化剂的条件下可以被空气中的氧气催化氧化生成乙醛与水,该反应的化学方程式为:2CH3CH2OH+O2Cu
本题解析:
本题难度:一般