1、填空题 如图是一些重要工业生产的转化关系(反应条件略去):
请完成下列问题:
(1)若D是单质,且与A属于同一主族,则.
①反应的化学方程式是______.
②D的原子结构示意图是______.
③D单质的一种重要用途是______.
(2)若B为黄色固体,D为固体化合物,则
①该反应的化学方程式是______.
②生产该工业品的工厂应建在离______较近的地方.
③实验室检验C的方法是______.
(3)若B是一种有刺激性气味的气体,则
①B的分子形状是______.
②实验室进行此实验时,常看到有大量白烟产生,请说明产生大量白烟的原因______.
③化合物C在一定体积的容器中,在一定条件下发生反应,测得容器内气体的压强略小于原来的
,请写出该反应的化学方程式______.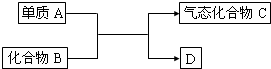
参考答案:(1)D与A同主族,A能置换出D,且该反应是重要反应,则分析元素周期表,可知A是C,D是Si,即2C+SiO2?高温?.?2CO+Si.Si的原子结构示意图是
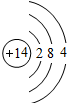
,硅单质的一种重要用途是制半导体材料,故答案为:2C+SiO2?高温?.?2CO+Si;

;制半导体材料;
(2)①化合物B为黄色固体,中学阶段的黄色固体化合物有AgI、硫铁矿等,能用于工业生产的只能是用黄铁矿生成浓硫酸,即A是氧气,B是FeS2,C是SO2,因此化学方程式为4FeS2+11O2?高温?.?2Fe2O3+SO2,故答案为:4FeS2+11O2?高温?.?2Fe2O3+SO2↑;
②该反应用于工业生产硫酸,由于浓硫酸是腐蚀品,运输成本较高,且危险性大,因此建厂时应该选择在使用浓硫酸密集的地方,即工业区集中的消费中心,故答案为:消费中心;
③因为氯气和二氧化硫都能使品红试液褪色,所以利用二者化学性质的差别,实验室检验二氧化硫通常采用:将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色,
故答案为:将气体C通入品红溶液中,溶液褪色,将溶液加热,又恢复红色;
(3)①该反应为工业生产的转化关系,又实验室做该实验有白烟,结合中学阶段氨气与挥发性酸相遇会产生白烟的知识,可知该反应是工业上氨气催化氧化制取硝酸的反应,即
4NH3+5O2催化剂.△4NO+6H2O,因此B是NH3,C是NO.氨气分子是三角锥形,故答案为:三角锥形;
②实验室进行此反应,NO会被过量氧气氧化为NO2,进而与水反应生成硝酸,硝酸与氨气反应生成硝酸铵而产生大量白烟,即:生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟,故答案为:生成的NO气体被氧气氧化生成NO2,NO2与水反应生成的硝酸与NH3反应而产生大量白烟;
③NO在密闭容器中一定条件下可以分解为二氧化氮和一氧化二氮,发生的反应为3NO=NO2+N2O,由于存在2NO2?N2O4而容器内气体的压强略小于原来的23.
故答案为:3NO=NO2+N2O.
本题解析:
本题难度:一般
2、填空题 A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体.而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊.D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体.请回答下列问题:
(1)写出A、B、C、D、E、F的化学式______
(2)写出F和H反应的化学方程式______.
(3)写出下列反应的离子方程式:
①D+盐酸______.
②B+水______.
参考答案:因焰色反应为黄色,说明五种物质都含有钠元素,
根据钠及其化合物的性质,可推知各物质.
E为氯化钠,
可燃气体是氢气,B为钠,
无色无味气体H能使澄清石灰水变浑浊,则H为二氧化碳,
F和H也可反应生成C和另一种无色无味气体,则无色无味气体为氧气,F为过氧化钠,C为碳酸钠
?C、D与盐酸反应生成一种无色无味气体H,D和A可反应生成C,则D为碳酸氢钠,A为氢氧化钠,
?故答案:(1)NaOH、Na、Na2CO3、NaHCO3、NaCl、Na2O2
?(2)2 Na2O2+2CO2=2Na2CO3+O2
(3)①HCO3-+H+=CO2↑+H2O
?②2Na+2H2O=2Na++2OH-+H2↑
本题解析:
本题难度:一般
3、填空题 下图是化学中部分常见的氧化物和单质的转化关系。其中,氧化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题:
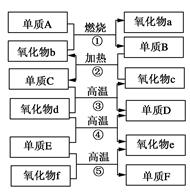
(1)写出下列物质的化学式:单质F________,氧化物d________。
(2)写出下列反应的化学方程式:
①_____________________________________________;
④_____________________________________________。
参考答案:(1)Si H2O
(2)①2Mg+CO2 C+2MgO ④C+H2O(g
C+2MgO ④C+H2O(g )
) CO+H2
CO+H2
本题解析:略
本题难度:一般
4、简答题 下图表示有关物质(均由短周期元素形成)之间的转化关系,其中A为常见的金属单质,B为非金属单质(一般是黑色粉末),C是常见的无色无味液体,D是淡黄色的固体化合物.(反应条件图中已省略.)
(1)A、B、C、D代表的物质分别为______、______、______、______(填化学式);
(2)反应①中的C、D均过量,该反应的化学方程式是______;
(3)反应②中,若B与F物质的量之比为4:3,G、H分别是______、______(填化学式);
(4)反应③产物中K的化学式为______;
(5)反应④的离子方程式为______.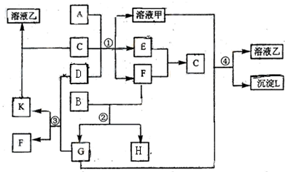
参考答案:题干信息,A为常见的金属单质,B为非金属单质(一般是黑色粉末)推断为C,C是常见的无色无味液体可以推断为H2O,D是淡黄色的固体化合物判断为Na2O2,E、F为O2和H2的反应生成水,A是常见金属,与另一种固体在水中反应生成O2和H2,则该固体金属为Al,固体D为Na2O2,能与水和CO2反应,则G为CO2;说明K为Na2CO3,F为O2; 题给信息黑色单质B与氧气(F)反应得到G(CO2),说明B为C(碳),C和O2反应可生成CO2和CO,则H为CO;依据F(O2)与E反应生成C(水)可知E为氢气;推断可知A为Al,B为C,C为H2O,D为Na2O2,E为H2,F为O2,G为CO2,H为CO,K为Na2CO3,
(1)依据推断可知,A、B、C、D代表的物质分别为:Al、C、H2O、Na2O2,故答案为:Al;C;H2O;Na2O2;
(2)反应①中的C、D均过量,生成的氢氧化钠溶液能和A完全反应,该反应的化学方程式是:2H2O+2Na2O2=4NaOH+O2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2H2O+2Na2O2=4NaOH+O2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(3)依据反应C+O2=CO2:n(C):n(O2)=1:1,发生反应产物为二氧化碳;依据反应2C+O2=2CO;n(C):n(O2)=2:1,发生反应生成一氧化碳气体;反应②中,若B(C)与F(O2)物质的量之比为4:3,1:1<n(C):n(O2)=4:3<2:1;判断G、H分别是:CO2、CO;故答案为:CO2;CO;
(4)反应③是过氧化钠和二氧化碳气体的反应生成碳酸钠和氧气,F为氧气,产物中K为碳酸钠,化学式为:Na2CO3,故答案为:Na2CO3;
(5)分析判断G为CO2,溶液乙是碳酸钠溶液,G+溶液甲=溶液乙+沉淀L,所以甲溶液中的偏铝酸钠和二氧化碳反应生成氢氧化铝沉淀,反应④的离子方程式为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-,故答案为:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
本题解析:
本题难度:一般
5、填空题 已知某单质A在一定条件下能实现如下的转化: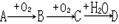
(1)?若A在常温下是气体,其氢化物的水溶液能使酚酞溶液变红,则A是?(写化学式),该氢化物中A元素的化合价为?
(2)?若A在常温下是黑色固体,C使澄清石灰水变浑浊,则D是?(写化学式)
(3)?若A在常温下是银白色固体,灼烧时产生黄色火焰,则C是?(写名称)
(4)?若A在常温下是黄色固体,D的浓溶液能使蔗糖变黑,
①?推出B是?(写化学式);
②?写出B→C的反应方程式:?;
③?若将B通入A的氢化物水溶液中,能观察到?现象,化学方程式为:
?;该反应中氧化剂和还原剂物质的量之比为:?
④?若将B通入BaCl2溶液中,未见有沉淀生成,若要使其产生沉淀,可往溶液中再通入一定量的某气体,该气体可能是?(填编号)
A.H2
B.Cl2
C.NH3
D.CO
参考答案:(1)? N2,-3?(各1分)(2)H2CO3(1分)(3)过氧化钠(1分)
(4)①SO2(1分)?②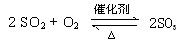 (2分)
(2分)
③产生黄色沉淀?(2分) ,? SO2+2H2S=3S↓+H2O?(2分),3:2(2分)④BC
本题解析: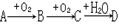 若A在常温下是气体,其氢化物的水溶液能使酚酞溶液变红为碱性气体,C使澄清石灰水变浑浊为CO2,若A在常温下是银白色固体,灼烧时产生黄色火焰为钠。若A在常温下是黄色固体,D的浓溶液能使蔗糖变黑,D为浓硫酸。
若A在常温下是气体,其氢化物的水溶液能使酚酞溶液变红为碱性气体,C使澄清石灰水变浑浊为CO2,若A在常温下是银白色固体,灼烧时产生黄色火焰为钠。若A在常温下是黄色固体,D的浓溶液能使蔗糖变黑,D为浓硫酸。
本题难度:一般