1、填空题 A、B、C、D为常见气态单质。已知:
①A和B可以在放电条件下发生化合反应,其产物还可与B化合生成红棕色气体;
②C分别与A、B反应生成的两种化合物分子中都含有10个电子;
③C和D反应生成的化合物易溶于水,在其溶液中滴加AgNO3溶液,生成白色沉淀。
请完成下列问题:
(1)C和D反应生成的化合物的电子式是_______________________。
(2)上述②中化合物的热稳定性_______________强于_______________。(填写化学式)
(3)将D通入B、C生成的化合物中,发生反应的化学方程式是________________________。
(4)A、C、D所含元素可组成一种离子化合物,该化合物发生水解反应的离子方程式是____________________________________。
参考答案:(1)
(2)H2O? NH3
(3)Cl2+H2O====HCl+HClO
(4)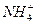 +H2O
+H2O NH3·H2O+H+
NH3·H2O+H+
本题解析:因为A和B可以在放电的条件下发生化合反应,其产物还可与B化合生成红棕色气体,所以A为N2,B为O2。C分别与N2、O2反应生成10e-化合物,则C为H2。D与H2反应生成化合物易溶于水,且与AgNO3溶液反应产生白色沉淀,D为Cl2。
本题难度:简单
2、简答题 已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物,B溶于水得蓝色溶液,它们有如下图所示的关系(反应中生成的水已略去).
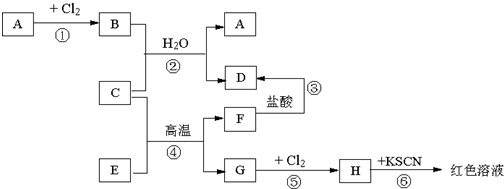
试回答下列问题.
(1)推断填写物质化学式:A是______,D是______,H是______.
(2)F的类别是______(选填“酸性氧化物”、“碱性氧化物”或“两性氧化物”).
(3)反应④的化学方程式为______.
参考答案:A、C、G是金属,G和氯气反应生成H,H和KSCN反应后溶液呈红色,说明H是FeCl3,所以G是Fe,C是金属单质、E和F是氧化物,G是Fe单质,结合反应条件知④发生铝热反应,则C是Al,F是Al2O3,E是Fe2O3,A是金属单质,和氯气反应生成氯化物,B溶于水得蓝色溶液,说明B中含有铜离子,则A是Cu,根据元素守恒知,B为CuCl2,Al和CuCl2发生置换反应生成Cu和AlCl3,D是AlCl3,Al2O3和HCl反应生成AlCl3,
(1)通过以上分析知,A、D、H分别是:Cu、AlCl3、FeCl3,故答案为:Cu;AlCl3;FeCl3;
(2)F是Al2O3,能和强酸、强碱反应生成盐和水,属于两性氧化物,故答案为:两性氧化物;
(3)铝和氧化铁发生铝热反应生成氧化铝和铁,反应方程式为:2Al+Fe2O3高温.Al2O3+2Fe,
故答案为:2Al+Fe2O3高温.Al2O3+2Fe.
本题解析:
本题难度:一般
3、填空题 (16分)下图中A~J均代表无机物或其水溶液,其中A是红棕色粉末,B、D、G是单质,B是地壳中含量最高的金属元素,G是气体,J是磁性材料。已知B可以在高温下与金属活性不如其强的其他金属的氧化物发生置换反应。
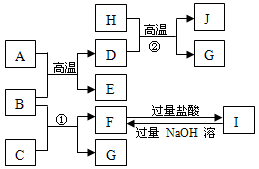
(1)写出下列物质的化学式:
A??E??I?
(2)反应①的离子方程式是??E是?氧化物(填碱性或酸性或两性)
F与过量盐酸反应的离子方程式是?
(3)J与盐酸反应的化学方程式是?
反应后的溶液与氯气反应的离子方程式是?
参考答案:(16分)(1)Fe2O3、Al2O3、AlCl3 (各2分)
(2)2Al? + 2OH-- + 2H2O =? 2AlO2- + 3 H2↑(2分)?两性(2分)
AlO2- + 4 H+ = Al3+ + 2H2O (2分)
(3)Fe3O4 + 8 HCl = 2FeCl3 + FeCl2 + 4H2O
2Fe2+ + Cl2= 2Fe3+ + 2Cl—
本题解析:此题为框图型推断题,解题的突破口有: B地壳中含量最高的金属,为Al,A为红棕色粉末,为Fe2O3,该反应为铝热反应,生成Fe和Al2O3;J为磁性材料,故为Fe3O4,②反应条件为高温,该反应为铁和水蒸气的反应G为氢气;B(Al)和C反应生成G(H2)和F,I加入过量NaOH得到F,故C为NaOH,F为NaAlO2。该题得解。
本题难度:一般
4、填空题 (14分)现有A、B、C、D四种物质,B、D的焰色反应均为黄色。C是一种酸式盐,将C加入BaCl2溶液有不溶于盐酸的白色沉淀生成,D晶体在干燥空气中容易逐渐失去结晶水变成白色粉末。对A、B、C、D进行下列实验,实验过程和记录如下图所示(无关物质已略去),请回答:
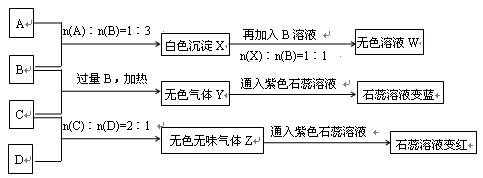
(1)X与B反应的离子方程式为 。
(2)D溶液pH值大于7,原因是(用离子方程式表示) 。
(3)写出C与过量B反应(加热)的离子方程式 __________________ 。
(4)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序_____________________.
(5)Y在同主族的同类物质中分子稳定性最强(?),也是沸点最高的(?)。(判断正误填"是"或"否")
(6)若向三份足量的B的稀溶液中分别加入少量稀醋酸、稀硝酸、浓硫酸,均生成1molH2O时的反应热分别为△H1 ,△H2,△H3 ,则三者由大到小排序为:___________________.
参考答案:(1) Al(OH)3+OH— = AlO2— +2H2O(2分)
(2)CO32—+ H2O  HCO3—+OH—?(2分)
HCO3—+OH—?(2分)
(3)NH4+ +H+ +2OH—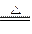 NH3↑+2H2O(3分)
NH3↑+2H2O(3分)
(4)C(Na+)>C(SO42-)>C(NH4+ )>C(H+) = C(OH-) (3分)
(5)是?,否?(各1分)?(6)△H1 >△H2?>△H3?(2分)
本题解析:略
本题难度:一般
5、填空题 A、B、C、D、E、F六种物质的相互转化关系如右图所示(反应条件未标出),其中反应①是置换反应。
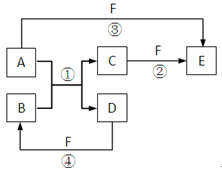
(1)若A、D、F都是非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是:?。
(2)若A是常见的金属单质,D、F是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是:?。
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,③和④两个反应中都有红棕色气体生成,B的结构式是:?;反应④的化学方程式是:?。
参考答案:(1)2C+SiO2 Si+2CO?(2)2Fe2++Cl2=2Fe3++2Cl-
Si+2CO?(2)2Fe2++Cl2=2Fe3++2Cl-
(3)O=C=O? C+4HNO3(浓)=4NO2↑+CO2↑+2H2O
本题解析:(1)若A、D、F都是非金属单质,反应①是置换反应,A、D同主族,根据框图可知,A与F生成E,C与F也能生成E,因此只能是SiO2与C反应,则A是C、B是SiO2、C是CO、D是Si,E是CO2、F是O2。
(2)若A是常见的金属单质,反应①是置换反应,D、F是气态单质,根据框图可知,A与F生成E,C与F也能生成E,因此A只能为Fe,D为H2,F为Cl2,B为HCl,C为FeCl2,E为FeCl3。
(3)若A、D为短周期元素单质,且所含元素的原子序数A是D的2倍,所含元素的原子核外最外层电子数D是A的2倍,反应①是置换反应,根据框图可知,A为Mg,D为C,B为CO2,C为MgO,又知③和④两个反应中都有红棕色气体生成,F为HNO3。
点评:本题综合性强,难度较大,一个框图适用三种情况,这要求学生对物质之间的反应必须熟练,尤其本题还涉及到了置换反应,在高中所学的置换反应是有限的,可以好好总结一下,能够提高做这类习题的效率。
本题难度:一般