1、选择题 已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出氢气。下列叙述正确的是( )
A.LiH的水溶液显中性
B.LiH中的氢离子可以被还原成氢气
C.LiH是一种强氧化剂
D.LiH中氢离子比锂离子的离子半径大
参考答案:D
本题解析:据题意: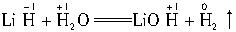 ,反应后生成LiOH,溶液显碱性,因LiH中
,反应后生成LiOH,溶液显碱性,因LiH中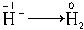 ,故H-被氧化,LiH是还原剂,Li+和H-的电子层结构相同,可判断离子半径H->Li+。
,故H-被氧化,LiH是还原剂,Li+和H-的电子层结构相同,可判断离子半径H->Li+。
本题难度:一般
2、选择题 下列分子中所有原子都满足最外层为8个电子结构的是(?)
A.BF3
B.CCl4
C.H2O
D.PCl5
参考答案:B
本题解析:只要分子中元素化合价的绝对值和该元素原子的最外层电子数之和满足8即能满足最外层为8个电子结构,据此可知选项B正确。答案选B。
本题难度:一般
3、选择题 在核电荷数为29的元素Cu的原子核外的3d、4s轨道内,下列电子排布图正确的是

参考答案:D
本题解析:由于电子处于全充满或半充满时稳定性强,所以选项D正确。
本题难度:一般
4、填空题 H、D、T的中子数分别是_________,质量数分别是_____________,
同位素原子的?虽然不同,但______________基本上完全相同;
16O、17O、18O属____________,O2、O3、O4属________________,
某元素的同位素原子可以形成3种分子量不同的双原子分子,
则该元素有_________种同位素原子。
参考答案:0 1 2 、 1 2 3 、中子数、化学性质、 同位素、 同素异形、2
本题解析:考查原子的组成以及同位素的概念等。质子数和中子数之和是质量数,质子数相同质量数不同的核素互称为同位素。而同素异形体是指由同一种元素形成的不同单质,所以16O、17O、18O属于同位素,O2、O3、O4则属于同素异形体。根据排列组合可知,若某元素的同位素原子可以形成3种分子量不同的双原子分子,则其同位素一定是两种。
本题难度:一般
5、填空题 (11分)下表为长式周期表的一部分,其中的编号代表对应的元素。
①
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
?
| ②
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ③
| ?
| ?
| ?
| ?
|
?
| ④
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ⑤
| ?
| ⑥
| ?
| ⑦
| ?
|
?
| ⑧
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| 
| ⑨
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
请回答下列问题:
(1)表中元素①的6个原子与元素③的6个原子形成的某种环状分子名称为?;③和⑦形成的一种常见溶剂的化学式为?,其立体构型为________________。
(2)某元素原子的外围电子排布式为nsnnpn+1,该元素原子的最外电子层上孤电子对数为?;该元素与元素①形成的最简单分子X属于?分子(填“极性”或“非极性”)。
(3)元素④的第一电离能?元素⑤(选填“>”、“=”、“<”)的第一电离能;元素⑥的电负性?元素⑦(选填“>”、“=”、“<”)的电负性。
(4)元素⑦和⑧形成的化合物的电子式为? ?。
?。
(5)元素⑨的基态原子核外电子排布式是 ? 。
(6)某些不同族元素的性质也有一定的相似性,如上表中元素②与元素⑤的氢氧化物有相似的性质。请写出元素②的氢氧化物与NaOH溶液反应的化学方程式:
__________________________________________________________________________
参考答案:
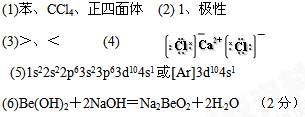
本题解析:略
本题难度:一般