1、填空题 (7分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
(3)根据下图操作及现象推断酸X为_______(填序号)。
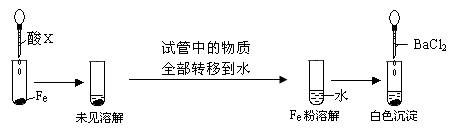 ?
?
a.浓盐酸? b.浓硫酸?c.浓硝酸?
2、计算题 某空气污染监测仪是根据SO2与Br2的定量反应来测定空气中SO2含量的。反应的溴来自一个装有酸性(稀硫酸)的KBr溶液的电解槽阳极的氧化反应,电解槽的阳极室与阴极室是隔开的。当测定某地区空气中SO2的含量时,空气(已除尘)以1.5×10-4m3/min的流速进入电解槽的阳极室,电流计显示电子通过的速率为8.56×10-11mol/s,此条件下能够保持电解槽中Br2浓度恒定并恰好与SO2完全反应(设空气中不含能与溴反应的其它杂质)。
(1)?写出此监测过程中发生反应的化学方程式。
(2)?计算该地区空气中二氧化硫的含量[单位:g/(m3空气)]。
3、选择题 50 mL18 mol·L-1硫酸溶液中,加入足量的铜片并加热,被还原的硫酸的物质的量 (? )
A.等于0.90 mol
B.等于0.45 mol
C.小于0.45 mol
D.大于0.45 mol、小于0.90 mol
4、选择题 某同学用地下水稀释浓硫酸,将浓硫酸沿玻璃棒注入盛地下水的烧杯中时,发现烧杯中溶液变浑浊,由此推测地下水中可能含有的离子是
A.Na+
B.Ba2+
C.Mg2+
D.K+
5、选择题 由NaHS、MgSO4、NaHSO3三种物质组成的某固体混合物中硫元素的质量分数为a%,则该混合物氧元素的质量分数为
A.a%
B.2a%
C.1~1.75a%
D.1~0.75a%