|
高考化学知识点归纳《电解池原理》考点巩固(2019年最新版)(四)
2019-05-30 02:59:28
【 大 中 小】
|
1、填空题 I.铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛。
(1)金属铝的生产是以Al2O3为原料,与冰晶石(Na3A1F6)在熔融状态下进行电解,其阴极电极反应式为 ,其电极均由石墨材料做成,则电解时不断消耗的电极是 (填“阴极”或“阳极”),冰晶石的作用为 。
(2)铝电池性能优越,A1-Ag2O电池可用作水下动力电源,化学反应为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则负极的电极反应式为 ,正极附近溶液的pH (填“变大”“不变”或“变小”)。
已知:①2Al(s)+3Cl2(g)=2AlCl3(s) △H1=-1390 .8kJ/mol
②4Al(s)+3O2(g)=2Al2O3(s) △H2=-3339.6kJ/mol
③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol
Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H= 。
Ⅱ.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)下图是在一定温度和压强下N2和H2反应生成1 mol NH3过程中的能量变化示意图,
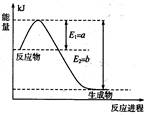
请写出合成氨的热化学反应方程式: (ΔH的数值用含字母a、b的代数式表示)。
(2)工业合成氨的反应为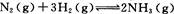 在一定温度下, 在一定温度下,
将一定量的N2和H2通入到体积为1 L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是&#来源:91考试网 91Exam.org160; 。
A.增大压强
B.增大反应物的浓度
C.使用催化剂
D.降低温度
| Ⅲ.铁及其化合物在生活、生产中有广泛应用。请回答下列问题。
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。 6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO2通入氯化铁溶液中反应的离子方程式: 。
Ⅳ.锰及其化合物应用越来越广泛,MnO2是一种重要的无机功能材料,制备Mn02的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为 。现以铅蓄电池为电源电解酸化的MnS04溶液,如图所示
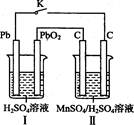
铅蓄电池的总反应方程式为 ,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为 ,MnO2的理论产量为 g。
参考答案:Ⅰ(1)Al3++3e-=Al;阳极;降低氧化铝熔点 (2) Al+4OH--3e-=AlO2-+2H2O;变大;-52.5KJ/mol
Ⅱ.(1)N2(g)+3H2(g) 2NH3(g)△H=-2(b-a)KJ/mol (2)AB 2NH3(g)△H=-2(b-a)KJ/mol (2)AB
Ⅲ (1)32 (2)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
Ⅳ.Mn2+一2e一+2H2O=MnO2+4H+ Pb+PbO2+2H2SO4=2PbSO4+2H2O 2 mol 87
本题解析:Ⅰ、(1)以Al2O3为原料,与冰晶石(Na3AlF6)在熔融状态下进行电解生成铝和氧气反应的化学方程式为:2Al2O3 4Al+3O2;阴极铝离子得到电子,电极反应式为Al3++3e-=Al;阳极上生成氧气消耗电极石墨;氧化铝的熔点高,冰晶石能降低氧化铝的熔点,故答案为:Al3++3e-=Al;阳极;降低氧化铝熔点; 4Al+3O2;阴极铝离子得到电子,电极反应式为Al3++3e-=Al;阳极上生成氧气消耗电极石墨;氧化铝的熔点高,冰晶石能降低氧化铝的熔点,故答案为:Al3++3e-=Al;阳极;降低氧化铝熔点;
(2)原电池中负极失去电子,则根据2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O可知铝在负极失去电子,则负极的电极反应式为Al+4OH--3e-=AlO2-+2H2O;正极氧化银得到电子,电极反应式为Ag2O+2e-+H2O=2 Ag+2OH-,所以正极附近溶液的pH变大;已知①2Al(s)+3Cl2(g)=2AlCl3(s) △H1=-1390 .8kJ/mol、②4Al(s)+3O2(g)=2Al2O3(s) △H2=-3339.6kJ/mol、③2C(s)+O2(g)=2CO(g) △H3=-221.0kJ/mol,则根据盖斯定律可知(③×3+①×2-②)÷2即得到Al2O3(s)+ 3C(s)+3Cl2(g)=2AlCl3(s)+3CO(g)的△H=(-221.0kJ/mol×3--1390 .8kJ/mol×2+3339.6kJ/mol)÷2=-52.5KJ/mol;
Ⅱ、(1)由图可知,N2和H2反应生成1molNH3放出的热量为(b-a)kJ,该反应的热化学反应方程式为N2(g)+3H2(g) 2NH3(g)△H=-2(b-a)kJ?mol-1,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1; 2NH3(g)△H=-2(b-a)kJ?mol-1,故答案为:N2(g)+3H2(g)?2NH3(g)△H=-2(b-a)kJ?mol-1;
(2)一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是:A.增大压强,平衡正向进行,但平衡常数不变,故A符合;B.增大反应物的浓度,平衡正向进行,平衡常数不变,故B符合;C.使用催化剂不能改变平衡,平衡不动,平衡常数不变,故C不符合;D.反应是放热反应,降低温度平衡向放热反应方向进行,平衡正向进行,平衡常数增大,故D不符合;故选AB;
Ⅲ、(1)3FeS2+8O2 6SO2+Fe3O4,有3mol FeS2参加反应,电子转移为8×2×2=32mol,故答案为:32; 6SO2+Fe3O4,有3mol FeS2参加反应,电子转移为8×2×2=32mol,故答案为:32;
(2)二氧化硫通入氯化铁溶液中发生反应,二氧化硫被氧化为硫酸,氯化铁被还原为氯化亚铁,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故答案为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+。
Ⅳ.阳极上锰离子失电子生成二氧化锰,电极反应式为Mn2+-2e-+2H2O=MnO2+4H+;铅蓄电池放电时,负极上铅失电子和硫酸根离子反应生成硫酸铅,正极上二氧化铅得电子和硫酸根离子反应生成硫酸铅,所以电池反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O,根据电池反应式知,当蓄电池中有4mol H+被消耗时,则电路中通过的电子的物质的量=2mol,根据转移电子相等得MnO2的理论产量=2mol/2××87g/mol=87g,故答案为:Mn2+-2e-+2H2O=MnO2+4H+;Pb+PbO2+2H2SO4=2PbSO4+2H2O;2mol;87。
考点:考查原电池、电解原理分析判断,化学平衡移动原理应用,平衡常数的概念分析判断,氧化还原反应电子转移数计算方法
本题难度:困难
2、选择题 把物质的量均为0.1mol的AlCl3、CuCl2和H2SO4溶于水制成100ml的混合溶液,用石墨做电极电解,并收集两电极所产生的气体,一段时间后在两极收集到的气体在相同条件下体积相同。则下列描述正确的是:
[? ]
A.电路中共转移0.9mol电子
B.阳极得到的气体中有O2,且其物质的量为0.35mol
C.阴极质量增加3.2g
D.铝元素以Al(OH)3的形式存在
参考答案:A
本题解析:
本题难度:一般
3、选择题 CuI是一种白色难溶于水的固体,以石墨作阴极,铜为阳极组成电解池,含有酚酞和淀粉KI的溶液作电解液,电解开始一段时间,阴极区溶液变红,阳极区为无色,电解相当长时间后,阳极区才呈深蓝色,则电解开始阶段的电极反应为( )
A.阳极:Cu-2e-===Cu2+阴极:Cu2++2e-===Cu
B.阳极:2Cu+2I--2e-===2CuI阴极:2H++2e-===H2↑
C.阳极:2I--2e-===I2阴极:2H++2e-===H2↑
D.阳极:4OH--4e-===2H2O+O2↑阴极:4H++4e-===2H2↑
参考答案:B
本题解析:阳极为Cu,在I-参与下,生成难溶CuI(阳极区为无色),阴极为H+放电。
本题难度:一般
4、填空题 (1)实验室电解饱和食盐水时发生反应的化学方程式为______.在______极产生无色气体,在另一极生成的气体能使______变蓝.
(2)研究性学习小组设计了如图所示的家用消毒液发生器,通电时,发生器内石墨电极上产生的氯气与电解液充分接触,制得有较强杀菌能力的消毒液(NaClO).则发生器内制取消毒液所涉及反应的化学方程式为______.
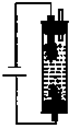
参考答案:(1)氯化钠和水在通电条件下生成氢氧化钠、氢气和氯气,反应的化学方程式为:2NaCl+2H2O通电.2NaOH+H2↑+Cl2↑;阳极上氯离子失电子生成氯气,氯气能使湿润的淀粉碘化钾试纸变蓝色;阴极氢离子得到电子生成氢气是无色气体,
故答案为:2NaCl+2H2O通电.2NaOH+H2↑+Cl2↑;阴;湿润的淀粉碘化钾试纸;
(2)氯化钠和水在通电条件下生成氢氧化钠、氢气和氯气,氯气在上升过程中与阴极生成的氢氧化钠溶液反应是次氯酸、氯化钠和水,制得有较强杀菌能力的消毒液(NaClO),制取消毒液所涉及反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O.
本题解析:
本题难度:一般
5、选择题 下列说法正确的是
A.电解稀硫酸溶液,溶液的浓度会逐渐变大,pH逐渐变大
B.氯碱工业中,电路中每转移1mol电子,理论上收集到1mol气体
C.向电解氯化钠溶液所得的稀溶液中,加入浓盐酸,能恢复到原溶液浓度
D.粗铜精炼时,粗铜应作电解池的阳极,电解质溶液在电解过程中浓度不变
参考答案:B
本题解析:A、惰性电极电解稀硫酸溶液,相当于是电解水,溶液的浓度会逐渐变大,酸性逐渐增强,所以pH逐渐变小,A不正确;B、氯碱工业中,电路中每转移1mol电子,理论上阴极和阳极分别收集到0.5mol氢气和0.5mol氯气,共收集到1mol气体,B正确;C、惰性电极电解饱和食盐水,得到氢氧化钠、氢气和氯气,所以向电解氯化钠溶液所得的稀溶液中,通入氯化氢气体,能恢复到原溶液浓度,C不正确;D、D、粗铜精炼时,粗铜应作电解池的阳极,但由于粗铜中含有锌、铁等活泼性强于铜的杂质,所以锌、铁等首先失去电子,而阴极始终是铜离子放电,所以电解质溶液在电解过程中浓度减小,D不正确,答案选B。
本题难度:一般
|  6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。
6SO2+Fe3O4,有3 m01FeS2参加反应,转移 mol电子。