1、选择题 用惰性电极实现电解,下列说法正确的是
[? ]
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
参考答案:D
本题解析:
本题难度:一般
2、选择题 若某电能与化学能的转化装置(电解池或原电池)中发生的总反应的离子方程式是Cu+2H+ Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
Cu2++H2↑,则下列关于该装置的有关说法中正确的是( )
A.该装置可能是原电池,也可能是电解池
B.该装置只能是原电池,且电解质溶液为硝酸
C.该装置只能是电解池,且金属铜为该电解池的阳极
D.该装置只能是原电池,电解质溶液不可能是盐酸
参考答案:C
本题解析:原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置。由题给总方程式知,Cu失电子,H+得电子。如果是原电池,Cu是负极,它的金属活动性排在氢之后,不可能发生反应,所以只能是电解池。
本题难度:一般
3、选择题 用含有少量银和锌的粗铜做阳极,纯铜片做阴极,CuSO4溶液做电解液,电解一段时间后,阳极质量减少了mg,则
A.电解液质量增加mg
B.阴极质量增加xg,x>m
C.阴极质量增加mg
D.阴极质量增加yg,y<m
参考答案:D
本题解析:
正确答案:D
阳极失电子先Zn - 2e- =Zn2+ 再 Cu - 2e- =Cu2+;阴极得电子Cu2+ +2e- =Cu; Zn的原子量比Cu大,那么粗铜单位质量给出的电子少于纯铜,又因为阳极失电子应该等于阴极得电子量,所以所以粗铜减少质量大于纯铜增加质量,选D
A、不正确,电解液质量增加少于mg,部分铜又析出;? B.不正确,阴极质量增加xg,x<m; C.阴极质量增加少于mg?。
本题难度:一般
4、填空题 某温度下将一定量密度为1.15g/cm3的NaCl溶液用石墨电极直流电,设NaCl恰好完全反应,且无其它反应发生,得到的溶液中氧元素的质量分数为80%。
(1)求电解后溶液中溶质与溶剂的物质的量之比;
(2)求原NaCl溶液的物质的量浓度。
参考答案:1)1:10
(2)4.5mol/L
设:NaOH的物质的是来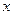 ,H2O的物质的量为
,H2O的物质的量为
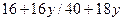 ="80%?"
="80%?" 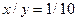
NaON的物质的量为1 mol则反应前的水为11 mol
C=1000×1.15×58.5÷(58.5+11×18)/58.5="4.5" mol/L
本题解析:略
本题难度:简单
5、选择题 (14分)“氢能”将是未来最理想的新能源。
Ⅰ 在25℃,101KPa条件下,1 g氢气完全燃烧生成液态水时放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为 。
Ⅱ 氢气通常用生产水煤气的方法制得。其中CO(g)+ H2O(g) CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
CO2(g)+H2(g) △H<0。在850℃时,平衡常数K=1。
(1)若升高温度至950℃,达到新平衡状态时K (填“>”、“<”或“=”)1。
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0 molCO、3.0mol H2O、1.0 molCO2和x mol H2,则:
①当x = 5.0时,上述平衡向 (填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是 。
③若设x="5.0" mol和x="6.0" mol,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a (填“>”、“<”或“=”)b。
Ⅲ 海水淡化获得淡水的过程也可以产生氢气。下面是利用电渗析法处理海水获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:

(1)阳离子交换膜是指______________ (填A或B)。
(2)写出通电后阳极的电极反应式:_________________________________________,在阴极区观察到的现象是:_________________________________________。
参考答案:ⅠH2(g)+ 1/2O2(g)=H2O(l) △H=-285.8kJ/mol(2分)
Ⅱ(1)<(1分)(2) ①逆反应(2分)②0≤x<3或x<3(2分)③<(2分)
Ⅲ (1)B(1分) (2)2Cl--2e-
本题解析:
本题难度:困难