1、选择题 下列关于甲、乙、丙、丁四幅图说法正确的是
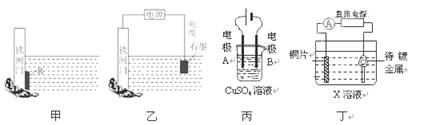
A.装置甲中对于铁闸门的保护用的是“牺牲阳极的阴极保护法”,焊接在铁闸上的金属R可以是锡块
B.装置乙中对于铁闸门的保护采用的是“外加电流的阴极保护法”,铁闸门应与直流电源的负极相连
C.装置丙可实现电解精炼铜,电极A的材料用纯铜,电极B的材料用粗铜
D.装置丁可实现镀铜,铜片接在电源的正极,待镀金属接在电源的负极,X溶液应用含有待镀金属阳离子的溶液
参考答案:B
本题解析:铁的活泼性强于锡的,A不正确,应该用锌快;C不正确,粗铜精炼时,粗铜做阳极,和电源的正极相连;D不正确,X溶液应用含有镀层金属阳离子的溶液,答案选B。
点评:该题是电化学的综合应用,试题基础性强,难度不大。该题的关键是明确电化学的原理,然后结合题意灵活运用即可,有助于培养学生的逻辑思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
2、选择题 以惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
A.0.1mol
B.0.2mol
C.0.3mol
D.0.4mol
参考答案:D
本题解析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入?Cu(OH)2后溶液与电解前相同,则铜离子和OH-离子均放电。
Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,?即电解生成了0.1 mol H2SO4,并消耗0.1 mol H2O,由电解的总反应式
2H2O+2CuSO4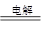 2Cu+O2↑+2H2SO4?转移电子
2Cu+O2↑+2H2SO4?转移电子
2mol?4mol
0.1mol?0.2mol
2H2O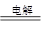 2H2↑+O2↑?转移电子
2H2↑+O2↑?转移电子
2mol? 4mol
0.1mol? 0.2mol
所以电解过程中共转移电子为0.4 mol,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确电解池的工作原理,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量,有利于培养学生的逻辑推理能力和逆向思维能力。
本题难度:简单
3、填空题 氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
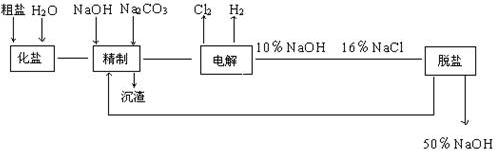
依据上图,完成下列填空:
(1)与电源负极相连的电极附近,溶液pH值(选填:不变、升高或下降),与电源正极相连的电极叫?极,检验该极上产物的方法是?。
(2)写出电解饱和食盐水的化学方程式?。
(3)如果粗盐中SO 含量较高,必须添加钡式剂除去SO
含量较高,必须添加钡式剂除去SO ,该钡试剂可以是(选填A.B.c,多选扣分)?
,该钡试剂可以是(选填A.B.c,多选扣分)?
A.Ba(OH)2? B.Ba(NO3)2? C.BaCl2?
(4)判断钡试剂已经过量的方法是?。
(5)为有效除去Ca2+、Mg2+、SO ,加入试剂的合理顺序为(选填a,b,c多选扣分)
,加入试剂的合理顺序为(选填a,b,c多选扣分)
A.先加NaOH溶液,后加Na2CO3溶液,再加钡试剂?
B.先加NaOH溶液,后加钡试剂,再加Na2CO3溶液?
C.先加钡试剂,后加NaOH溶液,再加Na2CO3溶液
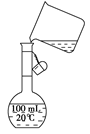
(6)为检验精盐纯度,需配制150 mL0.2 mol/LNaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是?。
参考答案:(1)升高?阳极?将淀粉碘化钾试纸用水润湿后粘在玻璃棒一端,靠近装有待测气体的集气瓶 如果黄绿色气体能使试纸变蓝色,证明含有Cl2。
(2)电解饱和食盐水的反应:2NaCl+2H2O  ?2NaOH+Cl2↑+H2↑
?2NaOH+Cl2↑+H2↑
(3)C
(4)静止,向上层清液中继续滴加BaCl2,如不产生沉淀,已过量。
(5)B.C。
(6)未用玻璃棒引流? 100 mL的容量瓶不能配制150 mL 溶液
本题解析:(1)与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH升高;与正极相连为阳极,生成氯气;将淀粉碘化钾试纸用水润湿后粘在玻璃棒一端,靠近装有待测气体的集气瓶 如果黄绿色气体能使试纸变蓝色,证明含有Cl2。
(2)电解饱和食盐水的反应:2NaCl+2H2O  ?2NaOH+Cl2↑+H2↑
?2NaOH+Cl2↑+H2↑
(3)添加钡试剂除去SO42-,注意不能引入新的杂质,选Ba(NO3)2会引入杂质硝酸根离子,所以该钡试剂不能选用。同理Ba(OH)2则引入了OH-离子。
(4)静止,向上层清液中继续滴加BaCl2,如不产生沉淀,已过量。
SO42-、Ca2+、Mg2+等分别与BaCl2溶液、Na2CO3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na2CO3溶液能除去过量的BaCl2溶液,盐酸能除去过量的Na2CO3溶液和NaOH溶液,所以应先加BaCl2溶液再加Na2CO3溶液,最后加入盐酸。故答案为:B.C。
(6)未用玻璃棒引流;100 mL的容量瓶不能配制150 mL 溶液。
本题难度:一般
4、填空题 (16分)如图所示,通电5 min后,电极5的质量增加了2.16 g,回答:

(1)电源:a是________极,C池是________池。
A池阳极电极反应式为__________________,阴极电极反应式为__________________。
C池阳极电极反应式__________________,阴极电极反应式为_____________________。
(2)如果B槽中共收集到224 mL气体(标准状况),且溶液体积为200 mL(设电解过程中溶液体积不变),则通电前溶液中Cu2+的物质的量浓度为______________________。
(3)如果A池溶液也是200 mL(电解过程中溶液体积不变),则通电后,溶液的pH为[________。
参考答案:(1)负 电解 2Cl--2e-===Cl2↑? 2H++2e-===H2↑
Cu-2e-===Cu2+? 2Ag++2e-===2Ag? (2)0.025 mol·L-1 (3)13
本题解析:(1)电极5的质量增加了2.16 g,说明电极5是阴极,则电极6是阳极,所以b是电源的负极,a是电源的负极。则电极1、3是阴极,电极2、4是阳极。A中阳极是氯离子放电,产生氯气。阴极是氢离子放电,产生氢气。C中阳极是铜,属于活性电极,铜失去电子。阴极是溶液中的银离子放电,析出银。
(2)B是电解硫酸铜,阳极是OH-放电产生氧气。阴极先是铜离子放电,析出铜,然后是氢离子放电产生氢气。电极5的质量增加了2.16 g,所以析出的银是0.02mol,转移电子是0.02mol。则B中生成氧气是0.005mol,体积是0.005mol×22.4L/mol=112ml,所以氢气也是112ml。根据电子守恒可知,铜离子得到的电子是0.02mol-0.005mol×2=0.01mol,因此铜离子的物质的量是0.005mol。则硫酸铜的浓度是0.005mol÷0.2L=0.025mol/L。
(3)根据反应式2NaCl+2H2O 2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.02mol,其浓度是0.1mol/L,所以pH=13。
2NaOH+H2↑+Cl2↑可知,生成的氢氧化钠是0.02mol,其浓度是0.1mol/L,所以pH=13。
本题难度:一般
5、选择题 按如图所示装置进行下列不同的操作,说法不正确
的是?(?)
A.铁腐蚀的速度由大到小的顺序是:只接通K1>只
闭合K3>都断开>只闭合K2
B.只接通K1,一段时间后,U形管中出现白色沉淀
C.只接通K2,U形管左、右两端液面均下降
D.先只接通K1,一段时间后,漏斗液面上升,然后再