1、填空题 常温下,在20.0mL 0.20mol/LCH3COONa溶液中滴加0.20mol/L的稀盐酸。溶液的Ph值的变化关系如右图所示。
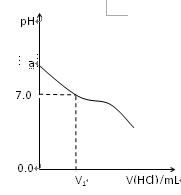
(1) a >7.0的理由是(用离子方程式表示)?
(2)如图,当加入稀盐酸的体积为V1mL时,溶液的pH值刚好为7.0。此时溶液中c(Cl-)?c(CH3COOH)(填<、>或=)。简要写出判断依据?
(3)当加入的盐酸的体积为20.0mL时,测定溶液中的c(H+)为1.3×10-3 ?mol/L,求CH3COH的电离平衡常数Ka(计算结果保留两位有效数字)。
参考答案:(1)CH3COO- + H2O  ?CH3COOH + OH-?(3分)
?CH3COOH + OH-?(3分)
(2) ="?" (2分) 根据电荷守恒有:c(OH- ) + c(Cl- ) + c(CH3COO- ) = c(H+) + c(Na+) 由于溶液的pH=7,c(OH- ) = c(H+),所以c(Cl- ) + c(CH3COO- ) = c(Na+)(2分);而根据物料守恒有:c(CH3COO H) + c(CH3COO- ) ="?" c(Na+)(1分)?所以有c(CH3COO H) = c(Cl- )(1分)
(3)解:当加入盐酸的体积为20.0mL时,两种物质刚好完全反应,生成c(CH3COOH) =" 0.10mol/L?"
CH3COOH  ?CH3COO- + H+
?CH3COO- + H+
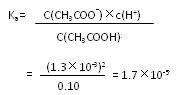
本题解析:略
本题难度:简单
2、选择题 甲溶液的pH=3,乙溶液的pH=1,则甲溶液中c(H+)与乙溶液中c(H+)之比
A.100
B.1/100
C.3
D.1/3
参考答案:B
本题解析:略
本题难度:简单
3、填空题 某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的离子积KW=?。在此温度下,将 pH = a的 NaOH 溶液 Va L 与 pH = b的 H2SO4溶液 Vb L 混合。
(1)若所得混合液为中性,且 a= 12,b= 2,则 Va∶Vb=?;
(2)若所得混合液为中性,且 a+ b= 12,则 Va∶Vb=?;
(3)若所得混合液的 pH = 10,且 a= 12,b= 2,则 Va∶Vb=?。
参考答案:(12分)
KW=10-13
(1)1:10?(2)10:1?(3)1:9
本题解析:解:0,01mol/l的NaOH溶液中C(OH-)=0.01mol/L=10-2mol/L,
pH为11的氢氧化钠溶液中C(H+)=10-11mol/L。
该温度下水的离子积常数Kw=C(H+)*C(OH-)= 10-11mol/L*10-2mol/L=10-13(mol/L)2。
①pH=12的NaOH溶液中C(H+)=10-12mol/L
则氢氧化钠溶液中C(OH-)=Kw/C(H+)=10-13(mol/L)2/10-12mol/L=10-1mol/L
pH=2的硫酸中C(H+)=10-2mol/L,
若所得混合液为中性,则C(H+)*Vb=C(OH-)*Va,
Va:Vb=10-2:10-1=10-2:10-1=1:10。
②所得混合液为中性,则C(H+)*Vb=C(OH-)*Va;且 a+ b= 12,
Va:Vb=C(H+):C(OH-)=C(H+):[Kw/C(H+)]=10-b:10-13+a=1013-a-b=10:1。
③pH=12氢氧化钠溶液中C(OH-)=10-1mol/L,
pH=2的硫酸中C(H+)=10-2mol/L,
pH=10的溶液中C(OH-)=10-13(mol/L)2/10-10mol/L=10-3mol/L,
若所得混合液的pH=10,则说明碱过量,
C(OH-)*Va-C(H+)*Vb=10-1mol/L*Va-10-2mol/L*Vb=(Va+Vb)*10-3mol/L,
解得:Va:Vb=1:9。
点评:
1、强酸、强碱溶液的pH
强酸直接由酸的浓度求出c(H+),强碱先由碱的浓度求出c(OH-),再根据水的离子积换算出c(H+),然后用公式Kw = c(H+)·c(OH—)=1×10-14?pH=" -" lg c(H+)求解
2、两强酸混合抓住氢离子进行计算? 2、两强碱混合抓住OH-进行计算,再转化为H+
c (H+) = 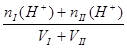 ?c (OH-])=
?c (OH-])= 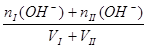
经验规律:(1)两强酸等体积混合?混合后的pH=小的+0.3
(2)两强碱等体积混合?混合后的pH=大的—0.3
3、强酸、强碱混合,酸过量抓住氢离子进行计算、碱过量抓住氢氧根离子进行计算。
(3)酸I+碱II
完全中和:c(H+)=? c(OH-) =? 1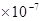 mol/L?
mol/L?
酸过量: c(H+)= 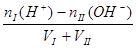 ?碱过量:c(OH-)=
?碱过量:c(OH-)= 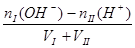
本题难度:一般
4、选择题 一定温度下,某NaCl稀溶液中c(H+)为1×10-6 mol·L-1,下列说法正确的是(?)
A.该NaCl溶液显酸性
B.该NaCl溶液中Kw=1×10-14
C.该NaCl溶液稀释10倍后pH=7
D.该NaCl溶液中Kw=1×10-12
参考答案:D
本题解析:A. NaCl是强酸强碱盐。水溶液为中性。在室温下,中性溶液的pH=7,酸性溶液pH<7.但是该实验温度不清楚。因此在NaCl溶液中c(H+)为1×10-6 mol/L不是酸性溶液。错误。B.Kw= c(H+) ·c(OH-)= 1×10-12 mol2/L2.错误。C.该NaCl溶液是中性溶液,pH=6,再进行稀释,无论稀释多少倍,溶液仍然为中性,pH=6.错误。D.由B的计算可知Kw=1×10-12 。正确。
本题难度:一般
5、选择题 已知101KPa时辛烷的标准燃烧热为—5518kJ·mol-1,含20gNaOH的稀溶液与稀盐酸充分反应放出热量28.7kJ,则下列热化学方程式书写正确的是
①C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(g); △H = +5518 kJ·mol-1
②C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(l); △H = -5518 kJ·mol-1
③H+(aq)+ OH-(aq)= H2O(l); △H = -57.4 kJ·mol-1
④HCl (aq) + NaOH(aq) =NaCl(aq) + H2O(l); △H = —28.7 kJ·mol-1
A.①③
B.②③
C.②④
D.②