1、填空题 (1)室温下PH=2的某强酸稀释100倍,PH=_____,PH=12的某强碱稀释100倍,PH=____
(2)室温下,PH=2的HCl与PH=12的氨水等积混合后,溶液的PH_ __7(填>,<或=),原因是 _______________________________________________________________________________
__7(填>,<或=),原因是 _______________________________________________________________________________
(3)室温下,0.01mol/L的HCl与0.01mol/L的氨水混合后,溶液的PH___7(填>,<或=),原因是_______________________________________________________________________
(4)室温下,将PH=5的H2SO4溶液稀释10倍C(H+):C(SO42-)=_________
将稀释后的溶液再稀释100倍,C(H+):C(SO42-)=_________
(5)MOH和ROH两种一元碱的水溶液分别加水稀释时,PH变化如右图:下列叙述中正确的是()
A:MOH是一种弱碱
B:在x点,MOH完全电离
C:在x点C(M+)=C(R+)?
D:稀释前ROH溶液中C(OH-)是MOH溶液中C(OH-)的10倍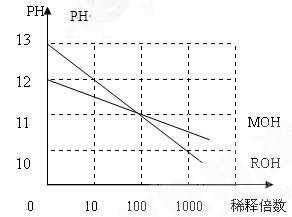
参考答案:(1) 4? ,  ?10 (
?10 ( 2)? > , 反应后剩
2)? > , 反应后剩 余大量氨水,氨水电离使溶液呈碱性(3) < , 生成的NH4Cl水解使溶液呈酸性NH4++H2O
余大量氨水,氨水电离使溶液呈碱性(3) < , 生成的NH4Cl水解使溶液呈酸性NH4++H2O NH3·H
NH3·H 2O+H+?(4)2:1? ,? 20:1? (5)B
2O+H+?(4)2:1? ,? 20:1? (5)B
本题解析:略
本题难度:一般
2、选择题 盖斯定律认为能量总是守恒的:化学反应过程一步完成或分步完成,整个过程的热效应是相同的。
已知:①H2O(g)===H2O(l); ΔH=-Q1 kJ/mol
②C2H5OH(g)===C2H5OH(l); ΔH=-Q2 kJ/mol
③C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g);ΔH=-Q3 kJ/mol
下列判断正确的是
A.酒精的燃烧热为Q3 kJ
B.若使46 g酒精液体完全燃烧,最后恢复到室温,释放出的热量为(3Q1-Q2+Q3)kJ
C.H2O(g)→H2O(l)释放出了热量,所以该过程为化学变化
D.从反应③可知1mol C2H5OH(g)能量高于2 mol CO2(g)和3 mol H2O(g)的总能量
参考答案:B
本题解析:
正确答案:B
A、不正确,表示的是气体乙醇的燃烧生成气态水的热化学方程形式,不是燃烧热,乙醇和水都要是液态;
C、不正确,是否为化学变化主要看是否有新物质生成而不是能量变化
D、不正确,还有氧气。
本题难度:一般
3、选择题 在标准状况下,将11.2L氢气在氯气中完全燃烧,放出92.4KJ热量,下列所示的热化学方程式正确的是(? )
A.H2(g)+Cl2(g)=1/2HCl(g) ΔH=92.4KJ/mol
B.H2(g)+Cl2(g)=1/2HCl(g) ΔH=-92.4KJ/mol
C.H2(g)+Cl2(g)=2HCl(g) ΔH=-184.8KJ/mol
D.H2(g)+Cl2(g)=2HCl(l) ΔH=184.8/mol
参考答案:C
本题解析:反应放热, ΔH<0,应从 B、C 中选,方程式中是1mol氢气反应,应放出184.8KJ的热量,故C 正确
本题难度:简单
4、判断题 在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
加入盐酸体积V/Ml
| 2
| 4
| 6
| 8
| 10
| 12
| 14
| 16
| 18
| 20
|
测得溶液温度t/ ℃
| 15.2
| 19.6
| 22.0
| 26.0
| 28.2
| 26.7
| 25.7
| 24.7
| 23.7
| 22.9
|
(1)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线。
(2)根据曲线讨论溶液温度变化的原因。
①加入盐酸的量在2—10 mL之间时:_____________________________________________;
②加入盐酸的量在10—20 mL之间时:____________________________________________。
(3)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:__________________________________________________________________________。
参考答案:(1)
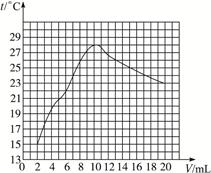
(2)①随盐酸量增加,中和反应放出热量增大,溶液温度上升
②过量盐酸起冷却降温作用,反应停止热量散失
(3)不合理,因为固体氢氧化钠溶于水也要放热
本题解析:用描点法将表格中的数据在图上表示出来,再连接成曲线。根据图象发现盐酸的量在2—10 mL时,随盐酸量增加,中和反应放出热量增大,溶液温度上升;当盐酸的量在10—20 mL之间,可能是盐酸已经过量,过量盐酸起冷却降温作用。不能用氢氧化钠固体,因为它在溶解过程中也会放热。
本题难度:简单
5、填空题 (1)将该温度下a mL pH="13" NaOH溶液与b mL0.05mol/L H2SO4混合,所得混合溶液的pH=7,
则a:b =?
(2)若在含有足量AgCl固体的饱和AgCl溶液中分别放入:
A.100mL蒸馏水中;
B.100mL 0.2 mol·L-1AgNO3溶液中;
C.100 mL 0.1 mol·L-1AlCl3溶液中;
D.100mL 0.1 mol·L-1盐酸溶液中。