1、选择题 完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述溶液的体积比为( )
A.1:1:1
B.3:2:1
C.9:3:1
D.6:3:2
参考答案:设AgNO3溶液的浓度都是c,体积分别为3V、2V、V,
NaCl、MgCl2、AlCl3溶液的浓度都是c1,设体积分别为x、y、z,
则完全沉淀时Cl-+Ag+═AgCl↓,
c1×x=c×3V,
c1×2×y=c×2V,
c1×3×z=c×V,
解得x:y:z=9:3:1,
故选C.
本题解析:
本题难度:简单
2、选择题 离子反应方程式能表示物质在溶液中进行离子反应的实质。下列反应的离子方程式的书写中,正确的是
A.硫酸溶液与氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓
B.将少量过氧化钠放入水中:Na2O2+H2O =2Na++2OH-+O2↑
C.用小苏打治疗胃酸过多:HCO3- +H+ = CO2↑+H2O
D.向氢氧化钠溶液中通入足量SO2气体:2OH-+ SO2 = SO32-+ H2O
参考答案:C
本题解析:A中还有水生成,A不正确;B中没有配平,不正确;D中SO2过量,应该生成亚硫酸氢钠,所以正确的答案选C。
点评:该题是高考中的高频题,属于中等难度的试题,试题侧重考查学生的能力。该题需要明确判断离子方程式正确与否的方法一般,即(1)检查反应能否发生。(2)检查反应物、生成物是否正确。(3)检查各物质拆分是否正确。(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等)。(5)检查是否符合原化学方程式,然后灵活运用即可。该题有助于培养学生分析问题、解决问题的能力。
本题难度:简单
3、选择题 下列实验现象所对应的离子方程式不正确的是
?
| 实 验
| 现 象
| 离子方程式
|
A
| 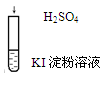
| 在空气中放置一段时间后溶液呈蓝色
| 4H+ + 4I- + O2 ="=" 2I2 + 2H2O
|
B
| 
| 开始时无气泡,后来有气泡
| CO32-+H+=HCO3-
HCO3-+H+ ="=" H2O+CO2↑
|
C
| 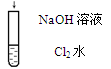
| 溶液由黄绿色变为无色
| Cl2 + 2OH- ="=" Cl- + ClO- + H2O
|
D
| 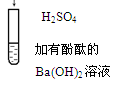
| 有白色沉淀生成,溶液由红色变为无色
| Ba2++OH-+H++SO42-="=" BaSO4↓+H2O
|
?
参考答案:D
本题解析:A、I-在酸性条件下与空气中的氧气发生氧化还原反应生成碘,溶液变蓝,正确;B、稀盐酸滴入碳酸钠溶液中,盐酸少量,开始生成碳酸氢钠,无气泡产生,继续滴加,盐酸与碳酸氢钠反应产生二氧化碳气体,正确;C、氯水呈黄绿色,加入氢氧化钠溶液后溶液为无色,是因为氯水中的氯气与氢氧化钠反应,氯气消失,溶液黄绿色消失,正确;D、离子方程式中的阴阳离子之比不符合氢氧化钡与硫酸的化学式中的阴阳离子之比,错误,答案选D。
本题难度:一般
4、简答题 2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X原子的结构示意图
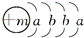
X的阳离子与Y的阴离子的电子层结构相同.元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子.
(1)m=______,该融雪剂的化学式为______.
(2)Z、W元素的名称为______、______.
(3)下列说法正确的是______.
A.XY2和WZ2都为离子化合物
B.XY2分子中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是______.
A.XY2的电子式:
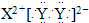
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-═2Y-+Z↓
D.用电子式表示XY2的形成过程为:
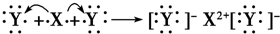
(5)冰雪的化学成分是H2O,水的沸点比H2Z的沸点高,其原因是______.
参考答案:(1)X为钙,Y为氯,所以m=20,融雪剂主要成分的化学式为CaCl2,故答案为:20;CaCl2;
(2)因Z为硫,W为碳,故答案为:硫;碳;
(3)A、因CS2是共价化合物,故A错误;
B、因CaCl2中仅含离子键,CS2中只含共价键,且是极性共价键,故B正确;
C、因氯的非金属性强于硫,所以稳定性HCl>H2S,故C错误;
D、核外电子排布相同的离子,原子序数越小,离子的半径越大,所以半径Ca2+<Cl-;
故选:B.
(4)A、CaCl2为离子化合物,电子式为:
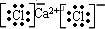
,故A错误;
B、CS2是直线形分子,结构式为S=C=S,故B正确;
C、Cl2与H2S水溶液反应的离子方程式为:Cl2+H2S═2H++2Cl-+S↓,故C错误;
D、CaCl2的形成过程为:
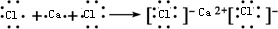
,故D正确;
故选:BD.
(5)因水分子中含有氢键,所以水的沸点比H2S的沸点高,故答案为:水分子中含有氢键.
本题解析:
本题难度:一般
5、选择题 下列离子方程式正确的是(?)
A.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓
B.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O
C.向苯酚溶液中滴加Na2CO3溶液: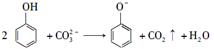
D.向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++ NO3-=3Fe3++NO↑+2H2O
参考答案:D
本题解析:A、氯化铝和氨水反应生成可溶性的氯化铵和氢氧化铝沉淀,所以其电离方程式为:Al3++3NH3·H2O═Al(OH)3↓+3NH4+;A错误;B、向NaHCO3溶液中加入少量Ca(OH)2溶液:,2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+CO32―,B错误;C、应生成HCO3―,C错误;D、正确,选D。
本题难度:一般