1、选择题 下列离子方程式正确的是(?)
A.铁与稀硫酸反应:2Fe + 6H+ = 2Fe3﹢ +3H2↑
B.Al(OH) 3沉淀中滴加盐酸:Al(OH)3 + H﹢ = Al3﹢+H2O
C.碳酸氢钠溶液中加入氢氧化钠:HCO3- + OH-= CO32- + H2O
D.碳酸钙与稀硝酸反应:CO32- + 2H+= CO2↑ + H2O
参考答案:C
本题解析:A错误,铁与稀硫酸反应生成亚铁离子,而不是铁离子。
B错误,电荷不守恒,元素不守恒。
C正确。
D错误,碳酸钙是难溶性的盐,书写离子方程时不能拆成离子形式。
本题难度:一般
2、选择题 下列离子方程式书写正确的是?
[? ]
A.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑ ?
B.向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O ?
C.向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列离子方程式书写正确的是( )
A.钢铁发生电化学腐蚀的负极反应:Fe-3e-=Fe3+
B.铜做电极电解饱和氯化钠溶液时的阳极反应:2Cl--2e-=Cl2↑
C.碳酸氢钠溶于水溶液呈碱性:HCO3-+H2O?H3O++CO32-
D.碳酸氢钠饱和溶液与硫酸铝溶液混合:Al3++3HCO3-=Al(OH)3↓+3CO2↑
参考答案:A.钢铁发生电化学腐蚀的负极反应为Fe-2e-=Fe2+,故A错误;
B.铜做电极电解饱和氯化钠溶液时的阳极反应为Cu-2e-=Cu2+,故B错误;
C.碳酸氢钠溶于水溶液呈碱性的离子反应为HCO3-+H2O?H2CO3+OH-,故C错误;
D.碳酸氢钠饱和溶液与硫酸铝溶液混合,相互促进水解生成沉淀和气体,离子反应为Al3++3HCO3-=Al(OH)3↓+3CO2↑,故D正确;
故选D.
本题解析:
本题难度:简单
4、填空题 某溶液中含有Ba2+、Cu2+和Ag+,现用氢氧化钠、盐酸和硫酸钠溶液将三种离子逐一沉淀分离。其流程如下图所示:(其中“溶液2”为无色溶液)
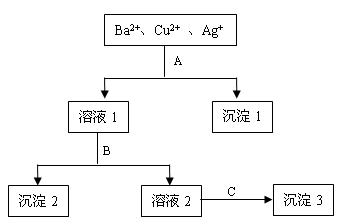
回答下列问题:
(1)沉淀1 的化学式:?。
的化学式:?。
(2)写出下列反应的离子方程式:
溶液1 + B:?。
溶液2 + C:??。
C:??。
参考答案:(1)AgCl(2分)
(2)Cu2+ + 2OH- ==Cu(OH)2↓(2分) Ba2+ + SO42- ="=" BaSO4↓(2分)
本题解析:略
本题难度:简单
5、简答题 硝酸与金属反应时,浓度越稀还原产物价态越低.现用一定量的铝粉与镁粉组成的混合物与100ml硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示.回答下列问题:
(1)写出铝与混合溶液反应的离子方程式______
(2)参加反应硝酸根离子物质的量为______mol
(3)参加反应的铝与镁的质量之比为______
(4)混合液中硫酸的物质的量的浓度为______mol/L.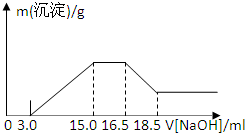
参考答案:(1)硝酸根浓度很低时被氧化的产物是铵根离子,因此无气体放出,镁、铝反应生成金属阳离子,则离子反应分别为4Mg+10H++NO3-═4Mg2++NH4++3H2O、8Al+30H++3NO3-=8Al3++3NH4++9H2O,
故答案为:8Al+30H++3NO3-=8Al3++3NH4++9H2O;
(2)由图示可以看出加入氢氧化钠溶液从15.0mL到16.5mL区间内发生的反应是氢氧根离子与铵根离子的反应,
由氮原子守恒可知,铵根离子的物质的量即为原溶液中反应的硝酸根离子的物质的量,
则原溶液中NO3-物质的量是(16.5-15)×10-3L×4mol/L=0.006mol,故答案为:0.006mol;?
(3)从图示提示中看出从氢氧化溶液体积16.5mL到18.5mL区间内发生的反应是氢氧化铝与氢氧化钠的反应,氢氧化铝与氢氧化钠等物质的量反应,
由Al~Al3+~Al(OH)3~NaOH,则Al的物质的量为0.008mol,
再由Mg2++2OH-═Mg(OH)2↓、Al3++3OH-═Al(OH)3↓,
沉淀镁离子和铝离子共消耗氢氧化钠溶液体积(15.0-3.0)mL,
由此可知:沉淀镁离子时消耗的氢氧根离子物质的量为(15.0-3.0)×10-3L×4.00mol/L-8×10-3mol×3=24×10-3mol,镁离子物质的量为1.2×10-2mol,
参加反应的镁与铝的质量之比:8×10-3mol×27g/mol:1.2×10-2mol×24g/mol=3:4,故答案为:3:4;
(4)由4Mg+10H++NO3-═4Mg2++NH4++3H2O、8Al+30H++3NO3-=8Al3++3NH4++9H2O可知,
消耗氢离子为0.008mol×308+1.2×10-2mol×104=0.06mol,
图中开始3.0mLNaOH溶液消耗氢离子的物质的量为3×10-3L×4mol/L=0.012mol,
原溶液中硫酸的物质的量为0.06mol+0.012mol2=0.036mol,
混合液中硫酸的物质的量的浓度为0.036mol0.1L=0.36mol/L,故答案为:0.36.
本题解析:
本题难度:一般