|
高考化学知识点整理《物质的量》高频考点巩固(2019年模拟版)(四)
2019-05-30 03:11:27
【 大 中 小】
|
1、选择题 在0℃和101 kPa的条件下,将4.00 g氩气、1.40 g氮气和1.60 g氧气混合,该混合气体的密度是相同条件下氢气密度的(? )
A.35倍
B.17.5倍
C.7倍
D.14倍
参考答案:B
本题解析:三种气体的物质的量分别是0.1mol、0.05mol和0.05mol,则混合气的平均相对分子质量是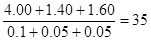 。由于在等温等压时,气体的密度之比是相应的摩尔质量之比,因此混合气的密度是相同条件下氢气密度的35÷17.5倍,答案选B。 。由于在等温等压时,气体的密度之比是相应的摩尔质量之比,因此混合气的密度是相同条件下氢气密度的35÷17.5倍,答案选B。
本题难度:一般
2、选择题 相同温度和压强下,等质量的下列气体中体积最小的是( )
A.O2
B.NO
C.N2
D.CO2
|
参考答案:D
本题解析:相同温度和压强下,气体体积最小,气体的物质的量最小,在质量相等的情况下,摩尔质量最大就行,在四个选项中只有摩尔质量最大的是二氧化碳,所以选D。
本题难度:一般
3、实验题 (6分)下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题:
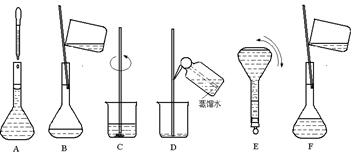
(1)用托盘天平称取Na2CO3·10H2O的质量是?。
(2)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是?。
(3)步骤B通常称为转移,步骤A通常称为?。
(4)将上述实验步骤A→F按实验过程先后次序排列?。
参考答案:(1)? 2.9g?(2)容量瓶?(3)定容?(4)CBDFAE
本题解析:配制 100 mL 0.100 mol·L-1 Na2CO3溶液配制 100 mL 0.100 mol·L-1 Na2CO3溶液需要Na2CO3·10H2O的物质的量为0.1L×0.100mol/L=0.010mol,则需要Na2CO3·10H2O的质量为0.01mol×286g/mol=2.86g,由于托盘天平只能称量到小数点后一位,所以需要Na2CO3·10H2O的质量为2.9g。步骤E为摇匀,需要的仪器是容量瓶。步骤A叫定容。配制溶液的步骤为:计算、称量、溶解、转移、洗涤、定容、摇匀,装瓶贴签。所以A→F按实验过程先后次序排列为CBDFAE。
点评:在计算所需溶质的质量时,要注意配制溶液的体积是否有相应的容量瓶,例如要配置480mL0.1mol/L的NaCl溶液,则计算时应该按500mL计算,因为没有480mL的容量瓶,只有500mL的容量瓶。
本题难度:一般
4、选择题 V?mL密度为ρ?g/mL的某溶液中,含有相对分子质量为M的溶质m?g,该溶液中溶质的质量分数为w%,物质的量浓度为c?mol/L,那么下列关系式正确的是
[? ]
A.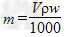 ? ?
B.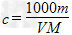
C.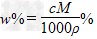 ? ?
D.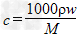
参考答案:B
本题解析:
本题难度:简单
5、计算题 工业上生产硫酸的原料,一种是黄铁矿,其主要成分为FeS2(S为-1价);另一种是磁黄铁矿,其主要成分是Fe1-xS(S为-2价),式中x通常为0.1~0.2,既含有Fe2+又含有Fe3+。
生产硫酸时将矿石煅烧,发生反应如下:
①? 4 FeS2 + 11 O2→ 2 Fe2O3 + 8 SO2?
②? 4 Fe1-xS + (7-3x) O2→ 2 (1-x) Fe2O3 + 4 SO2
含FeS272%的黄铁矿10吨,理论上最多可以生产98%的浓硫酸?吨(矿石中无其他含硫物质)。
若磁黄铁矿Fe1-xS中x=0.1,则Fe1-xS中Fe2+与Fe3+的物质的量之比为?:1。
煅烧矿石时,为了尽可能地将矿石中的硫转变为SO2,需通入过量20%的空气(其中N2与O2的体积比为4:1,假设无其他气体成分),计算磁黄铁矿充分煅烧后排出的气体中SO2的体积分数(用含x的代数式表示)。
参考答案:12?(2分)? 3.5?(3分)?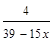 ?(3分) ?(3分)
本题解析:(1)FeS2中S元素的含量是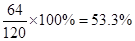
所以根据S原子守恒可知,最多可以生产98%的浓硫酸等质量为
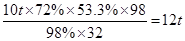
(2)设Fe1-xS中Fe2+与Fe3+的物质的量分别是a和b
则根据原子守恒和电荷守恒可知a+b=0.9、2a+3b=2
解得a=0.7mol,b=0.2mol
所以Fe1-xS中Fe2+与Fe3+的物质的量之比为3.5︰1。
(3)设生成4mol SO2,则需要1.2 (7-3x)mol的O2,所需空气中的N2为4.8 (7-3x)mol;
反应后得到的混合气体组成为:SO2 4mol、O2 0.2 (7-3x)mol、N2 4.8 (7-3x)mol;
所以 SO2的体积分数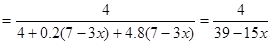
点评:该题以黄铁矿和磁黄铁矿生产浓硫酸为载体,重点考查学生对化学计算的熟悉掌握情况,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范的答题能力。该题的关键是在掌握反应原理的基础上利用好守恒法。
本题难度:一般
|