1、填空题 硫磺在科学技术和生产中有重要的应用。石硫合剂是一种很好的植物杀虫剂,它是硫磺与石灰、水等反应所得――由多硫化钙[ CaSx(x≤5)]、硫代硫酸钙组成的混合物。不同比例的石灰和硫磺在水溶液中反应,可生成不同的多硫化钙和硫代硫酸钙。如:
3Ca(OH)2+8S 2CaS3+CaS2O3+3H2O;
2CaS3+CaS2O3+3H2O;
3Ca(OH)2+6S 2CaS2+CaS2O3+3H2O等。
2CaS2+CaS2O3+3H2O等。
根据题意完成下列计算:
(1)、硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,通过计算确定Na2Sx中x=?。
(2)、取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/mL)通入足量CO2使其快速分解。原理如下:
Sx2-+2H2O+2CO2→(x-1)S↓+H2S↑+ 2HCO3-,S2O32- + H2O+CO2→HSO3-+HCO3-+S↓ 。
完全反应后共收集到气体1.12升(S·P·T)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为?;硫代硫酸钙的质量分数为?。(答案用小数表示,保留2位有效数字)
(3)、如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是?;多硫化钙的化学式是?。
(4)、现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙。请推算这二种多硫化钙可能的物质的量之比(写出推算过程)。
参考答案:(1)、4?(2分)?(2)、0.20 mol/L (2分)? 0.014?(2分)
(3)、2:1?(2分)? CaS5?(2分)
(4)、n(CaO)="50.4/56" =0.3mol? n(S)="96/32" =3mol?(1分)?
则 n[Ca(OH)2 ]: n(S) =" 3" : 10?由反应可知:3Ca(OH)2+10S 2CaSx+CaS2O3+3H2O
2CaSx+CaS2O3+3H2O
解之得:x="4" 即多硫化物中硫原子的平均值为4.?(1分)
故另两种多硫化物可能为:CaS2与CaS5或CaS3与CaS5。?(2分)
由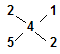 ?可知,n(CaS2):n(CaS5)=1:2;(1分)
?可知,n(CaS2):n(CaS5)=1:2;(1分)
由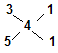 ?可知,n(CaS3):n(CaS5)=1:1?(1分)
?可知,n(CaS3):n(CaS5)=1:1?(1分)
其他和理解法也可以给分。
本题解析:(1). 硫元素的质量分数为0.736,则钠元素的质量分数为0.264,所以钠原子和硫原子的个数之比是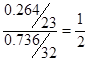 ,所以x=4.
,所以x=4.
(2)硫化氢是0.05mol,所以根据方程式可知,多硫化钙的物质的量是0.05mol,其浓度是0.05mol÷0.25L=0.20 mol/L。其中+CaS2O3的物质的量是0.05mol÷2=0.025mol,所以其质量分数是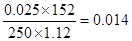 。
。
(3)生石灰、硫磺的质量比7:16,则物质的量之比是1︰4,即氢氧化钙和硫磺的物质的量之比是1︰4,所以方程式为3Ca(OH)2+12S 2CaSx+CaS2O3+3H2O,因此x=5。
2CaSx+CaS2O3+3H2O,因此x=5。
(4)n(CaO)="50.4/56" =0.3mol? n(S)="96/32" ="3mol"
则 n[Ca(OH)2 ]: n(S) =" 3" : 10?由反应可知:3Ca(OH)2+10S 2CaSx+CaS2O3+3H2O
2CaSx+CaS2O3+3H2O
解之得:x="4" 即多硫化物中硫原子的平均值为4.
故另两种多硫化物可能为:CaS2与CaS5或CaS3与CaS5。
由 可知,n(CaS2):n(CaS5)=1:2;
可知,n(CaS2):n(CaS5)=1:2;
由 可知,n(CaS3):n(CaS5)=1:1
可知,n(CaS3):n(CaS5)=1:1
本题难度:一般
2、选择题 在Na2SO4和Al2(SO4)3的混合溶液中,测得Al3+浓度为0.1mol/L,SO42-浓度为0.3mol/L,则混合溶液中Na+的浓度为(? )
A.0.15mol/L
B.0.45mol/L
C.0.6mol/L
D.0.3mol/L
参考答案:D
本题解析:
物质的量浓度的相关计算.
分析:根据溶液不显电性,利用电荷守恒即可计算混合溶液中Na+的浓度.
解:因Na2SO4和Al2(SO4)3的混合溶液不显电性,
Al3+浓度为0.1mol/L,SO42-浓度为0.3mol/L,设混合溶液中Na+的浓度为x,
根据电荷守恒可知,
0.1mol/L×3+x×1=0.3mol/L×2,
解得x=0.3mol/L,
故选D.
本题难度:简单
3、选择题 MgSO4和Al2(SO4)3溶液等体积混合后,铝离子的物质的量浓度为0.1mol/L,硫酸根离子的浓度为0.3mol/L,则混合液中镁离子的浓度为
[? ]
A.0.15mol/L
B.0.3mol/L
C.0.45mol/L
D.0.2mol/L
参考答案:A
本题解析:
本题难度:一般
4、选择题 下列溶液中的Cl-与50mL?1mol?L-1?AlCl3溶液中Cl-物质的量相等的是( )
A.150mL 1mol?L-1的NaCl溶液
B.75mL 2mol?L-1NH4Cl溶液
C.75mL 1mol?L-1的FeCl3溶液
D.150mL 2mol?L-1的KCl溶液
参考答案:A、150mL1mol?L-1的NaCl溶液中Cl-物质的量为0.15L×1mol?L-1=0.15mol,与50mL?1mol?L-1?AlCl3溶液中Cl-物质的量相等,故A正确;
B、75mL2mol?L-1NH4Cl溶液中Cl-物质的量为0.075L×2mol?L-1═0.15mol,与50mL?1mol?L-1?AlCl3溶液中Cl-物质的量相等,故B正确;
C、75mL1mol?L-1的FeCl3溶液中Cl-物质的量为0.075L×3mol?L-1=0.225mol,与50mL?1mol?L-1?AlCl3溶液中Cl-物质的量不相等,故C错误;
D、150mL2mol?L-1的KCl溶液中Cl-物质的量为0.15L×2mol?L-1=0.3mol,与50mL?1mol?L-1?AlCl3溶液中Cl-物质的量不相等,故D错误.
故选AB.
本题解析:
本题难度:一般
5、选择题 有K2SO4和Fe2(SO4)3的混合溶液,含Fe3+的物质的量浓度为0.1 mol/L,而SO42-的物质的量浓度为
0.3 mol/l,则混合液中K+的物质的量浓度为
[? ]
A.0. 15 mol/L
B.0.3 mol/L
C.0. 45 mol/L
D.0.6 mol/L
参考答案:B
本题解析:
本题难度:简单