1、选择题 下列化合物中,不能由单质直接化合而得到的是( )
A.NaCl
B.FeCl2
C.FeCl3
D.CuCl2
参考答案:A、Na与氯气在点燃时能直接生成NaCl,故A正确;
B、Fe和氯气在点燃时能直接生成FeCl3,故B错误;
C、Fe和氯气在点燃时能直接生成FeCl3,故C正确;
D、Cu与氯气在点燃时能直接生成CuCl2,故D正确;
故选:B.
本题解析:
本题难度:一般
2、选择题 经氯气消毒的自来水,若用于配制以下溶液,会使配制的溶液变质的是
①NaOH;②AgNO3;③Na2CO3;④FeSO4;⑤KI;⑥Na2S;⑦Na2SO3
A.全部
B.②④⑤⑥
C.②⑤
D.④⑥
参考答案:A
本题解析:氯气溶于水,发生化学反应:Cl2+H2O HCl+HClO。①NaOH+HCl="NaCl+" H2O.会变质。正确。②AgNO3+HCl=AgCl↓+HNO3.会变质。正确。③Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑会变质。正确。⑤Cl2+2KI=2KCl+I2?.会变质。正确。⑦Na2SO3 + Cl2+H2O= Na2SO4 + 2HCl会变质。正确。因此符合题意意的选项为A。
HCl+HClO。①NaOH+HCl="NaCl+" H2O.会变质。正确。②AgNO3+HCl=AgCl↓+HNO3.会变质。正确。③Na2CO3+ 2HCl=2NaCl+H2O+ CO2↑会变质。正确。⑤Cl2+2KI=2KCl+I2?.会变质。正确。⑦Na2SO3 + Cl2+H2O= Na2SO4 + 2HCl会变质。正确。因此符合题意意的选项为A。
本题难度:一般
3、选择题 化工生产中通常有“三酸两碱”之说,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是__________,(填化学式)。
(2)向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是__________(填序号)。
A.浓H2SO4具有脱水性
B.盐酸具有挥发性
C.气体溶质的溶解度随温度升高而降低
(3)“三酸”常用于溶解金属和金属氧化物
①下列块状金属在常温下能够全部溶于足量的浓硝酸的是______(填序号);
A.Au? B.Ag? C.Al? D.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式__________________________。
(4)烧碱、纯碱溶液均可吸收CO2气体。当含0.1molNaOH的溶液吸收一定量CO2后,将溶液低温小于蒸干,称得固体质量为8g,则所得固体是____________(填化学式)。
参考答案:(1)Na2CO3(1分)
(2)A(2分)
(3)①B(2分)②Cu+H2O2+2H+=2H2O(2分)
(4)NaHCO3、Na2CO3(2分)
本题解析:(1)Na2CO3属于盐,所以不恰当。
(2)浓硫酸具有吸水性,吸收浓盐酸中的水,促进HCl的挥发,与脱水性无关,故选A项。
(3)H2O2具有氧化性,在H+存在时把Cu氧化,Cu+H2O2+2H+=2H2O
(4)若CO2与NaOH全部生成Na2CO3,质量为5.3g,若全部生成NaHCO3,质量为8.4g,实际固体产物的质量为8g,所以反应生成了Na2CO3、NaHCO3的混合物。
本题难度:一般
4、填空题 (14分)瑞典化学家舍勒在研究软锰矿(主要成分是 )的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体——氯气。某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
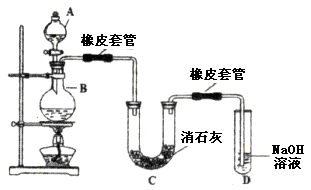
(1)A仪器的名称是__________,所盛试剂是__________,B中发生反应的化学方程式是__________。
(2)漂白粉将在U形管中产生,其化学方程式是____________________。
(3)此实验结果所得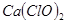 产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成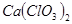 ,为避免此副反应的发生,可采取的措施是______________________________。
,为避免此副反应的发生,可采取的措施是______________________________。
②试判断另一个副反应(写出此反应方程式):____________________。为避免此副反应发生,应采取的措施是______________________________。
(4)漂粉精同盐酸作用产生氯气: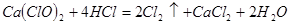 ,该反应中每生成
,该反应中每生成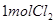 ,转移电子的物质的量为__________
,转移电子的物质的量为__________ ,被氧化的
,被氧化的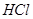 的物质的量为__________
的物质的量为__________ 。有效氯是漂粉精中有效
。有效氯是漂粉精中有效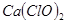 的含量大小的标志。已知:
的含量大小的标志。已知:
有效氯=(漂粉精加盐酸所释放出的氯气的质量/漂粉精的质量)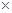 100%,该漂粉精的有效氯为65%,则该漂粉精中
100%,该漂粉精的有效氯为65%,则该漂粉精中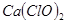 的质量分数为__________(保留一位小数)。
的质量分数为__________(保留一位小数)。
参考答案:1)分液漏斗,浓盐酸,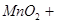
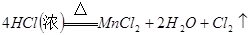 ,
,
(2)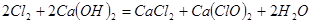 。
。
(3)①将U形管置于冷水浴中。
②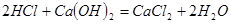 。在B、C之间增加一个饱和食盐水洗气装置。
。在B、C之间增加一个饱和食盐水洗气装置。
(4)1?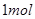 ? 65.5%
? 65.5%
本题解析:(1)A仪器的名称是分液漏斗,所盛试剂是浓盐酸,B中发生反应的化学方程式是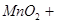
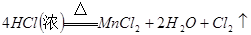 ;
;
(2)漂白粉将在U形管中产生,其化学方程式是: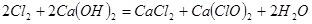
(3)①温度较高时氯气与消石灰反应生成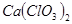 ,为避免此副反应的发生,可采取的措施是:将U形管置于冷水浴中。
,为避免此副反应的发生,可采取的措施是:将U形管置于冷水浴中。
②另一个副反应(写出此反应方程式):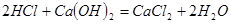 ;为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置。
;为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置。
(4)漂粉精同盐酸作用产生氯气: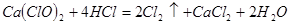 ,该反应中每生成
,该反应中每生成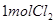 ,转移电子的物质的量为
,转移电子的物质的量为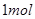 ,被氧化的
,被氧化的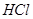 的物质的量为
的物质的量为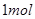 ;
;
本题难度:一般
5、填空题 (4分)以下是实验室制取氯气的装置,在图中饱和食盐水的作用是?,
浓硫酸的作用是?,F中盛放的溶液是?,起的作用是?。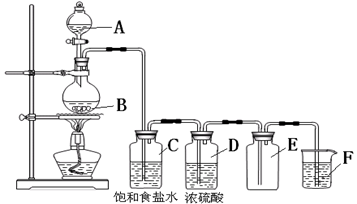
参考答案:吸收氯化氢;干燥;氢氧化钠溶液;吸收尾气
本题解析:考查氯气的制取、净化及收集及尾气处理
制氯气的反应原理为MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,由于浓盐酸易挥发,在所制气体中含有HCl及水蒸气,一般用饱和食盐水来吸收HCl,用浓硫酸来吸收水蒸气,最后用碱液来吸收过多的氯气,以防污染空气:2Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O,由于浓盐酸易挥发,在所制气体中含有HCl及水蒸气,一般用饱和食盐水来吸收HCl,用浓硫酸来吸收水蒸气,最后用碱液来吸收过多的氯气,以防污染空气:2Cl2+2NaOH=NaCl+NaClO+H2O
本题难度:简单