1、选择题 实验室用乙酸、乙醇与浓H2SO4制取乙酸乙酯,加热蒸馏后,在饱和Na2CO3溶液的上面得到无色油状液体,当振荡混合时,有气泡产生,原因是( )
A.H2SO4被蒸馏出来
B.有部分未反应的乙醇被蒸馏出来
C.有部分未反应的乙酸被蒸馏出来与Na2CO3反应
D.有部分乙醇跟浓H2SO4作用生成乙烯
参考答案:C
本题解析:
本题难度:简单
2、选择题 1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115-125℃,反应装置如图。下列对该实验的描述错误的是
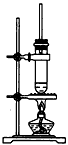
[? ]
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列关于实验原理或操作的说法中,不正确的是
[? ]
A.检验Cl-、Br-、I-可以选用氯水、四氯化碳
B.将一小粒钠放入盛满水的烧杯中,观察钠与水的反应
C.用溴水可以鉴别SO2和CO2两种气体
D.制备乙酸乙酯时,将浓硫酸缓缓加入到乙醇和乙酸的混合液中
参考答案:B
本题解析:
本题难度:一般
4、实验题 某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________________.此方案第一步的实验装置如下图所示
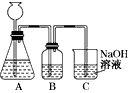
(2)加入反应物前,如何检验整个装置的气密性: __________________________________________
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是______________,作用是___________________________________
(4)在实验室通常制法中,装置A还可作为下列_________ (填序号)气体的发生装置
①HCl ②H2 ③Cl2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_______ mol/L.
参考答案:(1)HCO3-+OH-==CO32-+H2O
(2)可一次检查A、B的气密性:用止水夹夹住B、C间的乳胶管,然后从漏斗中注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,过一会,观察漏斗内与锥形瓶中的液面差,若保持不变,说明装置不漏气(或分别检查A、B的气密性:用弹簧夹夹住A、B间的乳胶管,先检查A的气密性:塞紧橡皮塞,从漏斗注入一定量的水,使漏斗中的水面高于锥形瓶内的水面,停止加水后,漏斗内与锥形瓶中的液面差保持不变,说明装置不漏气,然后检查B的气密性:向烧杯中注入少量水,使导管口浸入水中,双手捂住广口瓶片刻有气泡冒出,松开手后,有少量水进入导管形成水柱,说明装置不漏气)
(3)饱和碳酸氢钠溶液;吸收HCl气体
(4)②
(5)7.2 mol/L
本题解析:
本题难度:一般
5、实验题 某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液范发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、_______、_______等玻璃仪器。
(2)步骤1过滤的目的是______________。
(3)当步骤2中溶液的pH=8~9时,检验沉淀是否完全的方法是______________。
(4)步骤2中溶液的pH较难控制,可改用_______。
参考答案:(1)烧杯;漏斗
(2)除去铁等不溶于碱的杂质
(3)取上层清液,逐滴加入稀硫酸,若变浑浊则说明沉淀不完全,若不变浑浊则说明沉淀完全
(4)通入足量的CO2气体
本题解析:
本题难度:一般