1、实验题 某化学兴趣小组用铁矿石(主要成分为Fe2O3,还有SiO2、Al2O3等杂质)提取Fe2O3。操作过程如下:

(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是___,
(2)沉淀A中主要含有____,固体B是___;
(3)滤液Y中的阴离子除OH-、Cl-外,还有___;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式____。
2、简答题 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
(1)写出制备乙酸乙酯的化学方程式______.
(2)浓硫酸在实验中的作用是______、______.
(3)加热一段时间后,在试管B饱和碳酸钠溶液的液面上方有一层油层,在油、水交界处观察到有气泡产生,气泡的主要成分是______.
(4)停止加热,取下试管B,嗅闻管内液体气味,闻到更多的是刺激性气味,这是因为物质的挥发等因素导致产品混有杂质,如______和______等,为进一步验证产物中某些杂质存在,在保持试管B相对稳定情况下,沿试管内壁滴入紫色石蕊试液,静置片刻会在试管内油层下方明显看到液体呈现三种颜色,由上而下分别为红色、紫色、蓝色,其原因可能是______,故产品需进行提纯.
(5)已知乙醇能和氯化钙结合.将所得产品依次用饱和碳酸钠溶液、饱和食盐水、饱和氯化钙溶液洗涤油层,分别分液.用饱和食盐水洗涤去除油层中可能含有的______杂质,减少乙酸乙酯的溶解,并防止对下面操作产生不利影响.
(6)在上述操作后,在所得油状液体中加入无水硫酸钠充分振荡,倾倒出油状液体,再进行______(填提纯的操作方法),收集74~78℃的馏分即可获得较纯净的乙酸乙酯.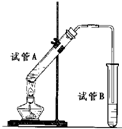
3、实验题 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及
CaCO3,步骤如下

请回答下列问题:
(1)溶液A中的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①为________(填代号),检验溶液A中Fe3+的最佳试剂为________(填代号)。
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4·5H2O,需要经过加热蒸发、________、过滤等操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是________________。
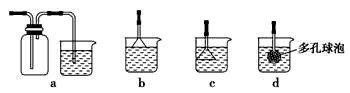
(3)制备CaCO3时,应向CaCl2溶液中先通入(或先加入)________(填化学式)。若实验过程中有氨气逸出,应选用下列________(填代号)装置回收。
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制某标准溶液,定容时视线应________,直到________。用KMnO4标准溶液滴定时应选用________管(填“酸式”或“碱式”)滴定。
4、选择题 某学习小组拟利用如下装置制备氮化钙(化学式:Ca3N2,极易与H2O反应),下列说法正确的是
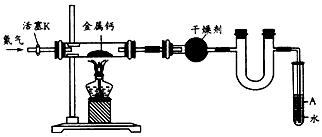
[? ]
A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以用碱石灰,也可以用浓硫酸
C.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
D.将产物Ca3N2放入盐酸中,只能得到一种盐
5、实验题 某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向溶液中滴加稀硫酸至溶液pH=8~9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液范发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
(1)上述实验中的过滤操作需要玻璃棒、_______、_______等玻璃仪器。
(2)步骤1过滤的目的是______________。
(3)当步骤2中溶液的pH=8~9时,检验沉淀是否完全的方法是______________。
(4)步骤2中溶液的pH较难控制,可改用_______。