| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《盐类水解的原理》高频考点特训(2019年练习版)(二)
参考答案:C 本题解析:A.根据图像可知,在溶液中存在H2R、HR-、R2-,说明H2R是弱酸。当溶液的pH=2时,c(H+)=c(HR-)=1×10-2mol/L,c(HR-)=c(H2R) 1×10-2mol/L ,所以H2R是二元弱酸,其 本题难度:困难 2、选择题 向稀硫酸溶液中逐渐加入氨水,当溶液中c(NH4+)=2c(SO42-)时,溶液的pH ( ) |
参考答案:A
本题解析:根据电荷守恒可知,2c(SO42-)+c(OH-)=c(NH4+)+c(H+)。所以如果溶液中c(NH4+)=2c(SO42-)时,c(OH-)=c(H+),即溶液显中性,答案选A。
本题难度:一般
3、选择题 下列溶液中有关物质的量浓度关系正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(CH3COOH) = 2c(Na+)
D.0.1mol·L-1的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2-)
参考答案:AC
本题解析:A、无论HA和MOH酸碱的强弱以及是否过量,溶液中只存在四种离子,且满足电荷守恒:c(H+) + c(M+) = c(OH-) + c(A-),A正确;B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)=c(OH-),但碳酸的酸性小于醋酸的酸性,所以c(CH3COONa)>c(Na2CO3),且两者都是水解产生OH-,物质的量浓度大于OH-的浓度,则c(NaOH)<c(Na2CO3)<c(CH3COONa),B错误;C、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合,根据物料守恒:c(CH3COO-) + c(CH3COOH) = 2c(Na+),C正确;D、0.1mol·L-1的NaHA溶液,其pH = 4而不是pH = 1,证明H2A不是强酸且NaHA电离大于水解使溶液呈酸性,c(HA-)>c(H+)>c(A2-)>c(H2A),D错误。答案选AC。
考点:考查离子浓度大小的比较、酸碱混合时的定性判断及PH的计算。
本题难度:一般
4、填空题 (10分)(1)现有NH4Cl和NH3·H2O组成的混合溶液,若其pH=7,则该溶液中c(NH4+)___c(Cl-);若pH>7,则该溶液中c(NH4+)______c(Cl-)。(填“>”、“<”、“=”).
(2)0.1mol/L的NaHCO3溶液中,按物质的量浓度由大到小顺序排列该溶液中各种微粒(水分子除外) ,c(Na+)+c(H+)=_______________ ,c(Na+)=____________
参考答案:(1)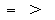 (2)c(Na+)> c(HCO3-)> c(OH-)> c(H2CO3)> c(H+)> c(CO32-)。c(Na+)+ c(H+)= c(HCO3-)+ c(OH-)+2 c(CO32-), c(Na+)= c(HCO3-)+c(H2CO3)+ c(CO32-)。
(2)c(Na+)> c(HCO3-)> c(OH-)> c(H2CO3)> c(H+)> c(CO32-)。c(Na+)+ c(H+)= c(HCO3-)+ c(OH-)+2 c(CO32-), c(Na+)= c(HCO3-)+c(H2CO3)+ c(CO32-)。
本题解析:(1)氯化铵和氨水的混合溶液,若pH=7,说明溶液为中性,即氢离子浓度=氢氧根离子浓度,根据电荷守恒,则铵根离子浓度=氯离子浓度。若pH>7,溶液为碱性,即氢离子浓度<氢氧根离子浓度,根据电荷守恒知铵根离子浓度大于氯离子浓度。(2)碳酸氢钠溶液中存在碳酸氢根电离和水解,水解大于电离,所以离子浓度大小顺序为: c(Na+)> c(HCO3-)> c(OH-)> c(H2CO3)> c(H+)> c(CO32-)。根据电荷守恒知道:c(Na+)+ c(H+)= c(HCO3-)+ c(OH-)+2 c(CO32-),根据物料守恒,即c(Na+)= c(HCO3-)+c(H2CO3)+ c(CO32-)。
考点:溶液中的离子浓度关系。
本题难度:一般
5、选择题 下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1 mol/L Na2CO3溶液:c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3)
B.0.1 mol/L NH4Cl溶液:c(NH4+) = c(Cl-)
C.向醋酸钠溶液中加适量醋酸,得到的酸性混合溶液:c(Na+) > c(CH3COO-) > c(H+) > c(OH-)
D.向硝酸钠溶液中滴加稀盐酸得到pH = 5的混合溶液:c(Na+) = c(NO3-)
参考答案:AD
本题解析:A、在碳酸钠溶液中存在质子守恒,即水电离出的氢离子浓度等于氢氧根离子浓度,由于碳酸根离子水解,所以有c(OH-) = c(HCO3-) + c(H+) + 2c(H2CO3),选A;B、氯化铵中有电荷守恒,c(NH4+)+ c(H+) = c(Cl-)+ c(OH-),因为铵根离子水解使溶液显酸性,氢离子浓度不等于氢氧根离子浓度,所以不选B;C、醋酸钠中加入醋酸,溶液显酸性,说明酸的电离大于盐的水解,所以醋酸根离子浓度大于钠离子浓度,不选C;D、硝酸钠中加入盐酸不反应,所以钠离子浓度一定等于硝酸根离子浓度,选D。
考点:溶液中的微粒关系。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《热化学方程.. | |