1、简答题 (1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是非通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是______(填“吸热”或“放热”)反应,NO2和CO的总能量______(填“>”、“<”或“=”)CO2和NO的总能量.
(2)在某体积为2L的密闭容器中充入1.5mol?NO2和2mol?CO,在一定条件下发生反应:NO2+CO═CO2+NO,2min时,测得容器中NO的物质的量为0.5mol,则:
①该段时间内,用CO2表示的平均反应速率为______;12min时,容器内气体的总物质的量为______.
③假设此反应在5min时达到平衡,则此时容器内气体的总物质的量______(填“大于”、“小于”或“等于”)2min时容器内气体的总物质的量.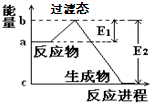
参考答案:(1)根据图象知:反应物的总能量大于生成物的总能量,根据能量守恒定律得,该反应是放热反应;NO2和CO是反应物,CO2和NO是生成物,所以NO2和CO的总能量>CO2和NO的总能量,故答案为:放热;>;
(2)①NO2 +CO═CO2 +NO
反应开始1.5mol? 2mol? 0? 0
2min时?1mol?1.5mol?0.5mol? 0.5 mol
CO2的平均反应速率=△nV△t=?0.5mol?2L2min=0.125mol/Lmin,
因为反应前后气体的计量数之和不变,所以反应前后气体的物质的量之和不变,故容器内气体的总物质的量为3.5mol;
故答案为:0.125mol/Lmin;3.5mol;
③因为反应前后气体的计量数之和不变,所以反应前后气体的物质的量之和不变,故容器内气体的总物质的量5min时和2min时一样,故答案为:等于.
本题解析:
本题难度:一般
2、选择题 下列有关说法错误的是( )
A.化学反应中一定有能量变化
B.能量变化一定能引起物质的变化
C.化学反应一定遵循质量守恒定律
D.化学反应一定遵循能量守恒定律
参考答案:A.化学反应的特点是有新物质生成.新物质和反应物的总能量是不同的,所以任何化学反应都伴随有能量变化.有些反应物和生成物的能量比较接近,这样的反应热效应不明显,但不是无能量变化.任何化学反应,反应前后的能量差值为化学反应中的能量变化,故A正确;
B.物质的变化,一定是化学变化;而能量变化不一定是化学变化,如冰融化成水,在来源:91考试网 91EXAm.org熔化的过程中,冰吸热,有能量变化;但冰和水是两种状态下的同一种物质.故B错误;
C.质量守恒定律是指:在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.原因是在化学反应中,原子的种类不变、.原子的数目不变,原子的质量不变,故C正确;
D.能量守恒定律是指:能量既不会凭空产生,也不会凭空消失,它只能从一种形式转化为其它形式,或者从一个物体转移到另一个物体,在转化或转移的过程中,能量的总量不变,故D正确.
故选B.
本题解析:
本题难度:一般
3、选择题 下列反应中,Q2>Q1的是? ( )
A.H2(g)+F2(g)=2HF(g) ΔH=-Q1 kJ·mol-1
H2(g)+Cl2(g)=2HCl(g) ΔH=-Q2 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-Q1 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-Q2 kJ·mol-1
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=-Q1 kJ·mol-1
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)ΔH=-Q2 kJ·mol-1
D.S(s)+O2(g)=SO2(g) ΔH=-Q1 kJ·mol-1