1、选择题 常温常压下,V1L的NO2和O2的混合气体,被水充分吸收后,剩余V2 L氧气,则原混合气体中NO2的体积为
A.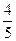 (V1-V2) L
(V1-V2) L
B.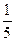 (V1+4V2) L
(V1+4V2) L
C.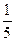 (V1-3V2) L
(V1-3V2) L
D.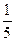 (4V1+3V2) L
(4V1+3V2) L
参考答案:A
本题解析:二氧化氮与氧气按下式反应:4NO2+O2+2H2O====4HNO3。
本题难度:简单
2、实验题 (本小题15分)用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166 g·mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术。ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+。
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是?>?>?。
(2)铁酸钠之所以能净水,除它本身具有强氧化性外,另一个原因可能是:
?。

(3)二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐。工业上用稍潮湿的KClO3和草酸在60℃时反应制得。某学生用如图所示的装置模拟工业制取及收集ClO2,其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置。请问:
①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置?;
②C中应装的试剂为?。C中发生反应的化学方程式为:
?。
参考答案:(1)ClO2? Cl2? Na2FeO4(5分)
(2)铁酸钠的还原产物Fe3+能水解生成Fe(OH)3胶体,能吸附水中悬浮物,从而净水(3分)
(3)①(冰水)冷凝(2分)? ②NaOH溶液(2分,其它合理也可)
2ClO2+2NaOH="==" NaClO2+NaClO3+H2O(3分,其它反应不是主要得分点)
本题解析:(1)设ClO2、Na2FeO4、Cl2的质量均为1 g,则被还原时,它们得到电子的物质的量分别为:ClO2: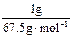 ×5=0.074 mol;Na2FeO4:
×5=0.074 mol;Na2FeO4: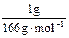 ×3=0.018 mol;Cl2:
×3=0.018 mol;Cl2: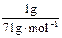 ×2=0.028 mol。故三种物质的消毒效率由大到小的顺序是ClO2>Cl2>Na2FeO4。
×2=0.028 mol。故三种物质的消毒效率由大到小的顺序是ClO2>Cl2>Na2FeO4。
(2)铁酸钠在消毒时,被还原为Fe3+,Fe3++3H2O Fe(OH)3+3H+,水解生成的Fe(OH)3胶体表面积较大,具有吸附性能,可吸附水中悬浮的杂质。
Fe(OH)3+3H+,水解生成的Fe(OH)3胶体表面积较大,具有吸附性能,可吸附水中悬浮的杂质。
(3)由题所给信息,二氧化氯的物理性质可知,二氧化氯被收集在B装置中,为提高收集效果,应补加冷凝装置。ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,所以尾气可用NaOH溶液吸收,发生歧化反应,生成NaClO2和NaClO3混合盐。技能空间:自身氧化还原反应中的“歧化”与“归中”。歧化反应:反应物自身氧化还原反应,同种元素一部分化合价升高,一部分化合价降低的反应。如Cl2 +2NaOH="==NaCl" +NaClO+H2O。归中反应:同一元素不同价态原子间发生氧化还原反应时:高价态降低为中间价态, 低价态升高为中间价态,也可归纳为:两相靠,不相交。若中间有多种价态,则原高价物质对应的还原产物价态仍高,原低价态的物质对应的氧化产物的价态仍低。如H2SO4(浓)+H2S===S↓+2SO2↑+2H2O,此反应中H2S不可能变为SO2,同样,H2SO4也不可能变为生成物中S。
应试策略:化学实验与化学计算放在一起进行综合考查是高考命题的趋势之一,考试大纲也提出明确要求:根据实验现象,观察、记录、分析或处理数据,得出正确结论。我们在复习化学实验知识的同时,绝对不能忽视对元素化合物、基本概念、理论、化学计算等方面知识的复习,高考化学考查的内容充分体现了学科内知识的系统性和综合性。
本题难度:一般
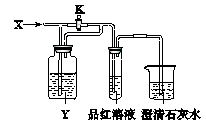
3、选择题 向如下图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。X和Y可能是
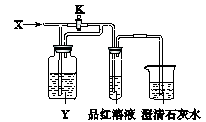
?
| A
| B
| C
| D
|
X
| SO2
| NO2
| HCl
| Cl2
|
Y
| 饱和NaHCO3溶液
| 水
| Na2SO3溶液
| Na2SO3溶液
参考答案:A
本题解析:本题可以采用排除法,A正确,B中NO2和水反应生成NO,NO不能使石灰水变混浊。C中生成SO2,能使品红溶液褪色。D中氯气和亚硫酸钠反应,生成硫酸钠和氯化氢,没有气体生成,不正确,所以答案选A。
本题难度:一般
4、选择题 向如下图所示的装置中缓慢地通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。X和Y可能是
?
| A
| B
| C
| D
| X
| SO2
| NO2
| HCl
| Cl2
| Y
| 饱和NaHCO3溶液
| 水
| Na2SO3溶液
| Na2SO3溶液
参考答案:A
本题解析:本题可以采用排除法,A正确,B中NO2和水反应生成NO,NO不能使石灰水变混浊。C中生成SO2,能使品红溶液褪色。D中氯气和亚硫酸钠反应,生成硫酸钠和氯化氢,没有气体生成,不正确,所以答案选A。
本题难度:一般
5、填空题 (6分)新制氯水中含有Cl2、H2O、HClO、H+、Cl-等粒子,根据下列性质选择恰当的粒子进行填空。
①使新制绿水呈现浅黄绿色的物质是___________________.
②能起杀菌消毒作用,光照易分解的弱酸是______________.
③能与硝酸银作用生成白色沉淀的离子是_______________.
参考答案:⑴C6H8O6?⑵羟基?⑶4
本题解析:
氯水的成分和性质
(1)反应原理及成分
Cl2+H2O==H++Cl- + HClO? HClO H+ + ClO-? 2HClO H+ + ClO-? 2HClO 2HCl + O2↑ 2HCl + O2↑
新制氯水中,所含的分子有:Cl2、H2O、HClO;离子有:H+、Cl-、ClO-、OH-(少量)
(2)氯水的性质
氯水的多种成分决定了它具有多重性质:①Cl2的强氧化性:②HCl的强酸性;③HClO的强氧化性、弱酸性;④Cl-的性质。在不同的反应中,氯水起作用的成分不同,现列表如下:
参与反应的微粒
所加试剂
实验现象
离子方程式或解释
Cl-
AgNO3溶液
白色沉淀
Cl- +Ag+ ="==" AgCl↓
H+
Na2CO3固体
有气泡产生
2H+ +CO32- ="==" CO2↑+ H2O
HClO
有色布条
布条颜色褪色
发生氧化还原反应
Cl2
FeCl2溶液
溶液变棕黄色
2Fe2+ + Cl2 ="==" 2Fe3++ 2Cl-
HClO、H+
石蕊溶液
先变红后褪色
酸性和漂白性
Cl2、H+
镁粉
氯水的颜色褪去并有气泡产生
Mg +Cl2 ="==" MgCl2
Mg + 2H+ ="==" Mg2+ +H2↑
本题难度:简单
|
|