1、选择题 下列说法正确的是( )
A.向久置的氯水中滴入紫色石蕊试液,溶液先变红后褪色
B.欲除去Cl2中的少量HCl气体,可将此混合气体通入盛有饱和食盐水的洗气瓶
C.漂白粉的有效成分是CaCl2和Ca(ClO)2,应密封保存
D.实验室用MnO2和稀HCl加热法制取Cl2,若有14.6 gHCl参加反应,则可制得7.1 g Cl2
参考答案:B
本题解析:Cl2+H2O=HCl+HClO,HClO具有强氧化性和漂白性,所以氯水滴入石蕊试液后先变红后褪色。Cl2在饱和食盐水中的溶解度小,HCl在饱和食盐水中的溶解度大,因此用饱和食盐水出去Cl2中的HCl。漂白粉的有效成分是Ca(ClO)2在空气中易与CO2和水蒸气反应而变质,所以要密封保存。实验室用MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O制氯气,当盐酸的浓度稀到一定程度该反应停止,因此14.6 gHCl参加反应,制取的氯气小于7.1g。答案选B。
MnCl2+Cl2↑+2H2O制氯气,当盐酸的浓度稀到一定程度该反应停止,因此14.6 gHCl参加反应,制取的氯气小于7.1g。答案选B。
点评:用MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O 法制取氯气时,不能用HCl的量计算Cl2的体积。
MnCl2+Cl2↑+2H2O 法制取氯气时,不能用HCl的量计算Cl2的体积。
本题难度:一般
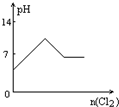
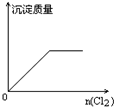
2、选择题 向H2S的水溶液中 通入一定量的Cl2,下列图象所示的变化正确的是( )
A.
B.

C.
D.
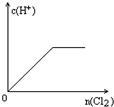
参考答案:H2S与Cl2发生反应:H2S+Cl2=2HCl+S↓,则
A.H2S为弱电解质,HCl为强电解质,溶液pH逐渐减小,故A错误;
B.H2S为弱电解质,HCl为强电解质,溶液离子浓度逐渐增大,故B错误;
C.生成S沉淀,当H2S反应完时,沉淀的量不变,故C正确;
D.开始时为H2S溶液,C(H+)>0,溶液呈酸性,故D错误.
故选C.
本题解析:
本题难度:简单
3、选择题 将等物质的量的HBr和SO2通入水中形成溶液,再向溶液中通入1 mol Cl2,有一半Br-转变为Br2,原混合气体中SO2的物质的量为 (?)?
A.0.8mol
B.1.6mol
C.2mol
D.4mol
参考答案:A
本题解析:HBr的还原性比SO2小,所以,通入1 mol Cl2时,氯气先与二氧化硫反应,二氧化硫反应完全后再与HBr反应;设混合气体中二氧化硫的物质的量为x,由方程式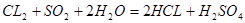 可得,x mol二氧化硫要消耗x mol氯气,由方程式
可得,x mol二氧化硫要消耗x mol氯气,由方程式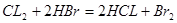 可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=
可得,由剩余氯气(1—x) mol要消耗2(1—x) mol的HBr,所以得2(1—x) mol=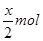 ,得x=0.8mol
,得x=0.8mol
本题难度:一般
4、填空题 (16分)
(1)下图为实验室制备、收集少量HCl的装置。
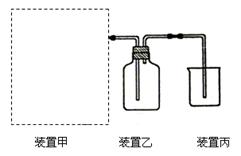
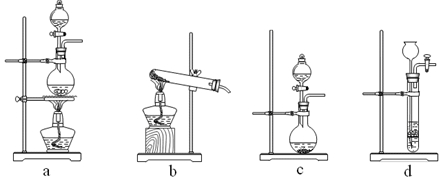
①制备HCl所用药品为浓硫酸和浓盐酸,则甲的最佳装置应选用下图中的?。
② 请解释能用浓硫酸和浓盐酸制备HCl气体的原因?。
③ 装置丙用来吸收过量的HCl气体,为防止倒吸,则烧杯中应该装入水和?。
(2)以下为苯的取代反应的探究实验。
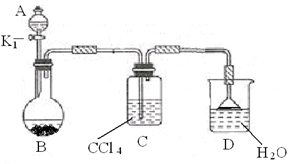
① 按上图所示的装置图连接好各仪器。
② 检验装置的气密性。
③ 在A中加入适量的苯和液溴的混合液体,在B中加入少量铁粉,塞上橡皮塞,打开K1,开始进行反应,放入适量混合液后,关闭K1。
写出B中发生反应的化学方程式?。
装置C的作用是?。
④ 反应结束后,用试管取少量D中的溶液,加入?
(描述试剂和现象),则证明B中的取代反应已经发生。
⑤ 把B中的固液混合物体过滤,分离出液体混合物,按下图方案精制含有苯和溴的溴苯。
其中试剂为 ?,操作名称为?。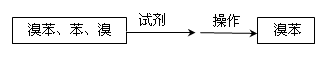
参考答案:(16分,每空2分)
(1)① c
② 浓硫酸具有强吸水性,吸收了浓盐酸中的水,同时放出大量的热,促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体
③ CCl4
(2)③
吸收溴和苯的蒸气。
④ 少量AgNO3溶液,如果有淡黄色沉淀生成。
⑤?NaOH溶液(或者Na2SO3溶液等合理答案) 、 分液、蒸馏
本题解析:(1)①利用浓硫酸与水混合时放热及浓盐酸的挥发性制取少量氯化氢,不需加热,所以选择c装置;
②利用了浓硫酸和浓盐酸的特性,浓硫酸具有强吸水性,吸收了浓盐酸中的水,同时放出大量的热,促进了HCl气体的挥发,所以可以用浓硫酸和浓盐酸制备HCl气体;
③为防止倒吸,除加入水外,还应加入比水密度大且氯化氢不溶于其中的液体物质,所以选择CCl4;
(2)③B中发生苯与溴在催化剂的作用下生成溴苯的反应,化学方程式为
溴与苯都易挥发,C中盛放四氯化碳,所以作用是吸收挥发的溴和苯的蒸汽;
④挥发的溴被C吸收,所以弱发生取代反应,则无机产物是溴化氢,溴化氢不溶于四氯化碳溶于水,所以若发生了取代反应,则D中有溴化氢存在,加入少量AgNO3溶液,会有淡黄色沉淀生成。
⑤粗溴苯中含有溴、苯杂质,所以应除去,加入氢氧化钠溶液可除去溴,此时溶液分层,分液后的油层中含苯和溴苯,再蒸馏可得溴苯。
本题难度:一般
5、实验题 在实验室里可用右图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。
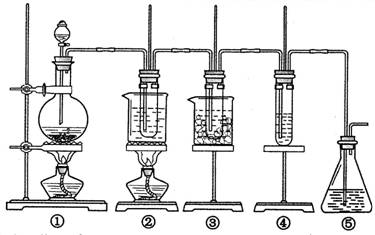
图中:①为氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于热水浴中;③的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;④的试管里加有紫色石蕊试液;⑤为尾气吸收装置。请填写下列空白:
(1)装置①是氯气发生装置,蒸馏烧瓶中盛放MnO2固体,其反应的化学方程式为?。
(2)如果实验室中MnO2用完了,则下列物质可能可以用来代替MnO2制Cl2的是:?
A.NaBiO3? B.FeCl3? C.PbO2?
已知氧化性强弱顺序为:NaBiO3>PbO2>MnO2>FeCl3
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是
①?;②?。
(4)反应完毕经冷却后,②的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是?(填写编号字母);从②的试管中分离出该晶体的方法是?(填写实验操作名称)。
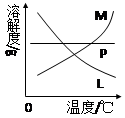
(5)根据④的试管里紫色石蕊试液的颜色变化可否证明氯气的强氧化性?。为什么??。
(6)一定量的氢气在氯气中燃烧,所得的混合物用100mL 3.00mol/L的NaOH溶液(密度为1.2g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。所得溶液中Cl-离子的物质的量??。
参考答案:(1)MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O?(2)A、C?
MnCl2+Cl2↑+2H2O?(2)A、C?
(3)①制取温度不同;? ②制取时碱的浓度也不同?(4)M?过滤
(5)不可,石蕊溶液褪色的是因为HClO的强氧化性而不是Cl2?(6)0. 250mol
本题解析:(1)实验室制氯气的反应为MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)根据氧化性的强弱可知比MnO2氧化性强的NaBiO3和PbO2都可以制氯气。
(3)比较②③两个装置中所装药品可知,制取氯酸钾和次氯酸钠的差别是:制取温度不同,制取时碱的浓度也不同。
(4)溶解度随温度变化较大的物质冷却后有晶体析出,所以M符合。分离的方法是过滤。
(5)氯气褪色,是因为氯水中的HClO有强氧化性和漂白性,所以不能证明氯气有强氧化性。
(6)100mL 3.00mol/L的NaOH溶液恰好完全反应,根据原子守恒,说明溶液中n(Cl-)+n(ClO-)=0.3mol。又知溶液中n(ClO-)=0.05mol,所以n(Cl-)=0.25mol。
点评:本实验题难度较大,综合性较强,有利于对学生解题思维的锻炼。
本题难度:一般