1、选择题 下列说法正确的是( )
A.光照氯水有气泡逸出,该气体是Cl2
B.新制氯水呈黄绿色是因为其中存在Cl2
C.久置氯水遇AgNO3溶液会产生白色沉淀
D.新制氯水经光照一段时间pH增大
参考答案:A、氯水中的次氯酸见光易分解为盐酸和氧气,所以光照氯水有气泡逸出,该气体是O2,故A错误;
B、氯气溶于水中得到氯水,是浅黄绿色的,故B正确;
C、久置的氯水成分是盐酸,含有氢离子和氯离子,向其中加入AgNO3溶液会产生白色沉淀氯化银,故C正确;
D、新制的氯水中的次氯酸见光易分解为盐酸和氧气,新制氯水经光照一段时间,即变为盐酸,酸性增强,pH变小,故D错误.
故选BC.
本题解析:
本题难度:简单
2、填空题 氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-.
试写出:
(1)(CN)2与KOH(aq)反应的化学方程式:____________________________;
(2)NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:_____________.
参考答案:(1)(CN)2+2KOH====KCN+KCNO+H2O
(2)2SCN-+(CN)2====(SCN)2+2CN-
本题解析:(1)类卤素的化学性质与卤素很相似,Cl2跟KOH(aq)反应的方程式为:Cl2+2KOH====KCl+KClO+H2O,那么(CN)2与KOH(aq)反应的方程式必然为:(CN)2+2KOH====KCN+KCNO+H2O
(2)因为阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-,故它们的单质氧化性强弱为:Cl2>Br2>(CN)2>(SCN)2>I2,因此在NaBr和KSCN的混合溶液中加入(CN)2,(CN)2不能氧化Br-,只能氧化SCN-.方程式为:(CN)2+2SCN-====2CN-+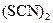
本题难度:简单
3、选择题 下列说法正确的是
A.煤的干馏、石油的分馏都是物理变化
B.工业上常用澄清石灰水和氯气反应制漂白粉
C.蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,都属于“盐析”
D.二氧化硅可以用于制造光导纤维,光导纤维遇强碱会“断路”
参考答案:D
本题解析:A.煤的干馏属于化学变化;B.工业上常用石灰乳(不是澄清石灰水)和氯气反应制漂白粉;C.蛋白质溶液中加入硫酸铵溶液和硫酸铜溶液均能产生白色沉淀,前者是盐析,后者是变性;D.SiO2能够与强碱反应生成硅酸盐,因此,光导纤维二氧化硅遇强碱会“断路”。
本题难度:简单
4、选择题 用玻棒蘸取新制氯水滴在pH试纸中部,观察到的现象是( )
A.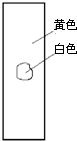
B.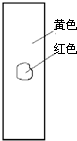
C.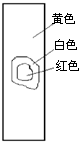
D.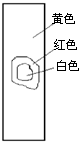
参考答案:由氯水的成分可知,含有氯气和次氯酸以及盐酸等成分,具有酸性,其中次氯酸的漂白是化学漂白,中间的一部分被次氯酸漂白形成白色,而旁边的一部分没有和次氯酸发生反应,所以仍然有指示剂的效用,氯水的酸性使得pH试纸显红色,只有D符合,
故选D.
本题解析:
本题难度:一般
5、选择题 实验室用浓盐酸与二氧化锰反应制取氯气,下列说法中正确的是(气体体积均在标准状况下测定)
A.若提供0.4molHCl,MnO2不足量,则可制得氯气2.24L
B.若提供0.4molHCl,MnO2过量,则可制得氯气2.24L
C.若有0.4molHCl参与反应,MnO2不足量,则可制得氯气2.24L
D.若有0.4molHCl被氧化,MnO2不足量,则可制得氯气2.24L
参考答案:C
本题解析:A错,HCL不能完全反应;B错,随反应的不断进行,浓盐酸会变为稀盐酸,稀盐酸不能与二氧化锰反应生成氯气;C正确;D错,若有0.4molHCl被氧化,MnO2不足量,则可制得氯气4.48L
本题难度:一般