1、填空题 (10分)铜是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:
(1)用惰性电极电解硫酸铜溶液时,若某电解质量增加16g,则另一电极的电极方程式为___________;该电极可收集到标况下气体____________L。
(2)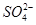 的立体构型是________,其中S原子的杂化轨道类型是_______;
的立体构型是________,其中S原子的杂化轨道类型是_______;
(3))元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为______;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______。
参考答案:(1)4OH-- - 4e- ==2H2O + O2; 2.8L。?(2)正四面体,sp3;
(3))5d106s1; 3:1
本题解析:(1) 惰性电极电解硫酸铜溶液,阴极和阳极的反应式分别为2Cu2++4e-=2Cu、4OH--4 e-==2H2O + O2 ↑,铜的物质的量是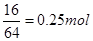 ,根据电荷守恒定律知气体的体积是
,根据电荷守恒定律知气体的体积是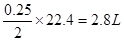 。
。
(2)根据价层电子对互斥模型知,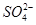 中中心原子的孤对电子数是0,价层电子对数是4,所以是正四面体构型,采用sp3杂化。
中中心原子的孤对电子数是0,价层电子对数是4,所以是正四面体构型,采用sp3杂化。
(3)立方体有6个面8个顶点,所以1个晶胞中含有的铜原子和金原子数分别为6×1/2=3,8×1/8=1,所以合金中Cu原子与Au原子数量之比为3:1。
(3)根据构造原理知Au原子最外层电子排布式为5d106s1(全充满或半充满最稳定)。
本题难度:一般
2、填空题 Ⅰ.实验室需配制500mL 0.2mol/L NaCl溶液
(1)本实验用到的仪器已有药匙、烧杯、量筒、托盘天平(砝码、镊子)、玻璃棒、胶头滴管,还缺少的玻璃仪器是?。
(2)配制时,需称取NaCl的质量是?g
(3)在配制过程中,其他操作都正确的情况下,下列操作会导致所配制的溶液浓度偏高的是?。(选填序号)
①没有洗涤烧杯和玻璃棒 ?
②加蒸馏水时,不慎超过了刻度,取出少量水使液面恰好到刻度线
③容量瓶不干燥,含有少量蒸馏水
④定容时仰视标线
⑤定容时俯视标线
Ⅱ.(10分)某催化剂为铁的氧化物,一化学兴趣小组在实验室里对该催化剂中铁元素的价态进行探究:查阅有关资料得知Fe2+能被酸性KMnO4溶液氧化而使酸性KMnO4溶液褪色;HNO3具有强氧化性。请完成对铁元素价态的探究:
(1)提出合理假设。
假设1:催化剂中铁元素为+3价;
假设2:?;
假设3:催化剂中铁元素既有+3价又有+2价
(2)设计实验方案。
(3)根据(2)的实验方案进行实验:
步骤1:取一定量的稀硫酸于试管中,加热煮沸数分钟,目的是?;
步骤2:取少量样品于试管中,加入处理过的硫酸并加热,得到A溶液;
步骤3:取A溶液于试管,滴加KSCN溶液,振荡,若不出现血红色,则假设?成立;若出现血红色,则假设1或3成立;
步骤4:为了进一步确定步骤3中是假设1还是假设3成立:另取A溶液于试管,加入KMnO4溶液,振荡,若出现?现象,则假设1成立;反之,则假设3成立。
(4)反思
某同学将步骤2中的稀硫酸改成稀硝酸得到了A溶液,向A溶液中滴加KSCN溶液后出现血红色,由此得出该催化剂中铁元素为+3价的结论。请判断该结论是否合理
?(填“合理”或“不合理”)。
参考答案:Ⅰ.(1)500 mL容量瓶(没有写容量瓶的容积和容量瓶字写错,不得分)(2分)
(2)5.9g(5.85,不得分)(2分)
(3)⑤(2分)
Ⅱ.(1)催化剂中铁元素为+2价(2分)
(3)除去硫酸中溶解的氧气(2分)步骤3:2(2分)?步骤4:高锰酸钾溶液不褪色(2分)
(4)不合理(2分)
本题解析:(1)配制溶液必须的玻璃仪器容量瓶,但注意容量瓶必须注明规格,如500 mL容量瓶;(2)配制500mL 0.2mol/L NaCl溶液,计算需NaCl5.85 g,但是托盘天平只能称量到0.1g,所以必须写明5.9g。(3)①偏低②偏低③无影响④偏低⑤偏高
Ⅱ.(1)根据所给的假设1和3可知,假设2应该是催化剂中铁元素为+2价
(3)由于氧气也具有氧化性,能氧化亚铁离子,所以加热煮沸数分钟的目的是除去硫酸中溶解的氧气。
步骤3:由于铁离子能和KSCN溶液反应显红色,所以若不出现血红色,则假设2成立。若出现血红色,则假设1或3成立。
步骤4:亚铁离子具有还原性,能被酸性高锰酸钾溶液氧化而褪色,所以如果出现高锰酸钾溶液不褪色现象,则假设1成立;反之,则假设3成立。
(4)由于硝酸具有氧化性,则加入硝酸会将Fe2+氧化成Fe3+,从而导致实验结论不准确。故不合理。
本题难度:一般
3、选择题 由FeO、Fe2O3、Fe3O4组成的混合物,测得其中铁元素与氧元素的质量比为21∶8,则这种混合物中FeO、Fe2O3、Fe3O4的物质的量之比可能为(? )
①1∶1∶1?②1∶2∶1?③1∶2∶3?④1∶1∶3
A.①和②
B.②和③
C.③和④
D.①和④
参考答案:D
本题解析: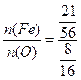 ?=3∶4。
?=3∶4。
可用代入法找出答案中铁与氧物质的量之比为3∶4 的即可。Fe3O4任意比,当FeO与Fe2O3满足物质的量之比为1∶1时即符合题意。
本题难度:简单
4、选择题 有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为( )
A.0.5 mol/L
B.3.0 mol/L
C.2.0 mol/L
D.1.0 mol/L
参考答案:D
本题解析:本题涉及的反应较多,若按各步反应进行计算则无从下手,可采用守恒法,由于得到沉淀最多时,溶液中的溶质只有NaCI,则n(HCI)=n(NaOH)=0.250×2.0=0.50moL,C(HCI)=1.0moL/L,D正确。
本题难度:一般
5、选择题 下列说法正确的是( )
A.工业上用C还原Al2O3产生Al
B.氯水能使红色花瓣褪色
C.常温下,硅与浓HNO3反应放出NO2
D.Fe(OH)2溶于NaOH溶液
参考答案:B
本题解析:
本题难度:一般