1、计算题 某工厂化验室为测定某黄铁矿(主要成分是FeS2)的纯度,取1.00 g矿石样品(所含杂质不挥发且不与氧气反应),在氧气流中充分灼烧,完全反应后,冷却,称量固体残留物,质量为0.75g。
(1)该黄铁矿中FeS2的质量分数为多少?
(2)该工厂用这种黄铁矿制硫酸,在FeS2燃烧过程中损失2%,由SO2氧化成SO3时,SO2的利用率为80%,吸收塔中SO3完全吸收。若煅烧10 .0t上述黄铁矿,则可制得98%的硫酸多少吨?
参考答案:(1)75%(2分);(2)9.8t(2分)
本题解析:略
本题难度:一般
2、填空题 (12分)A、B、C、D四种物质都含有一种共同的元素,A是常见的金属,C的溶液呈现黄色,A、B、C、D之间有如下所示转化关系。
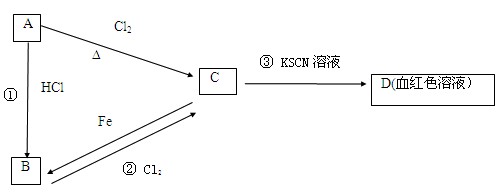
试回答下列问题:
(1)A是?,C是?。
(2)C的溶液与NaOH溶液混合后的现象是??。
(3)反应①的反应类型是?反应(选填“化合”“分解”“置换”“复分解”)。
参考答案:(12分)
(1)A是? Fe?,C是? FeCl3?。
(2)?产生红褐色沉淀?。
(3)?置换?。
本题解析:略
本题难度:一般
3、选择题 根据下列框图分析,下列说法正确的是( )

A.E3+的氧化性比M2+的氧化性弱
B.在反应①中硫酸既表现了酸性、又表现了氧化性
C.反应④的离子方程式可表示为:3SCN-+E3+ E(SCN)3↓
E(SCN)3↓
D.在③反应中若不加稀硫酸可能看到红褐色沉淀
参考答案:D
本题解析:M是红色金属,则可以确定是金属铜,在H2O2作用下与H2SO4反应生成CuSO4,Y遇到KSCN出现红色,Y中有Fe3+,则金属E是铁,X是FeSO4,经③步反应氧化为Fe2(SO4)3,与氨水反应得到红褐色的Fe(OH)3。Fe3+的氧化性比Cu2+的氧化性强,A错;在反应①中硫酸只表现了酸性,H2O2表现了氧化性,B错;SCN-与Fe3+反应生成的产物是可溶于水的配离子,C错;反应③为:2Fe2++H2O2+2H+ 2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
2Fe3++2H2O,可见反应过程消耗H+,pH增大,有可能会生成红褐色的Fe(OH)3沉淀,D正确。
本题难度:一般
4、填空题 (9分)已知B是常见金属单质,E为常见非金属单质,H常温下为无色液体。根据下列关系,试回答:
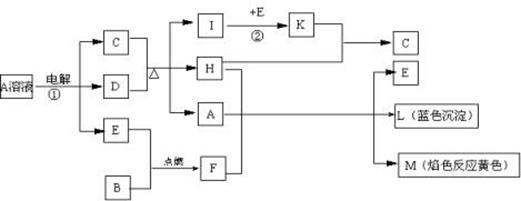
⑴L的化学式:?F的电子式:?。
⑵反应①的离子方程式:?。
⑶反应②,工业上采取的反应条件:??。
⑷每生成1molK,反应放出98.3kJ热量,该反应的热化学方程式为:
??。
参考答案:⑴Cu(OH)2?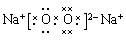
⑵2Cu2++2H2O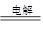 2Cu↓+O2↑+4H+?
2Cu↓+O2↑+4H+?
⑶常压,催化剂,400-500oC
⑷SO2(g) + 1/2 O2(g)  SO3(g);△H=-98.3kJ/mol
SO3(g);△H=-98.3kJ/mol
本题解析:(1)L是蓝色沉淀,M的焰色反应是黄色,H常温下为无色液体,判断H是水;说明A、F中含有Na、Cu元素,所以B是Na或是Cu;A、F与水反应生成钠的化合物、蓝色沉淀及E, 判断E是氧气,将Cu代入,不符合题意,所以B是Na,F是过氧化钠;C与D加热反应生成3种物质,I与氧气反应的产物K与水反应又得C,所以A是硫酸铜溶液,过氧化钠与水反应生成氧气和氢氧化钠,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀,所以L是Cu(OH)2,过氧化钠的电子式为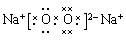 ;
;
(2)则反应①是电解硫酸铜的离子方程式,答案为2Cu2++2H2O 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
(3)铜与浓硫酸加热反应生成二氧化硫、水、硫酸铜,二氧化硫在常压、催化剂、400-500 ?C时与氧气反应生成三氧化硫,三氧化硫与水反应生成C硫酸;
(4)每生成1molSO3,反应放出98.3kJ热量,该反应的热化学方程式为SO2(g)+1/2O2(g)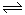 SO3(g)△H=-98.3kJ/mol。
SO3(g)△H=-98.3kJ/mol。
本题难度:一般
5、实验题 (14分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:

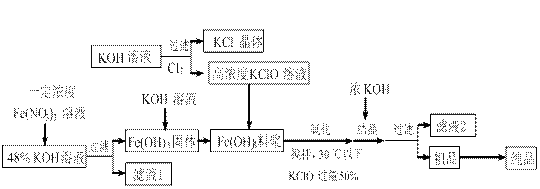
(1)在农业生产中,滤液1可用作? ?▲?。
?▲?。
(2)上述氧化过程中,发生反应的离子方程式是:?▲?,控制反应温度30℃以下的原因是:?▲?。
(3)结晶过程中加入浓KOH溶液的作用是:?▲?。
(4)某温度下,将Cl2通入KOH溶液中,反应后得到KCl、KClO、KCl O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为?▲?。
O3的混合溶液,经测定ClO-与ClO3-离子的物质的量之比是1:2,则Cl2与氢氧化钾反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为?▲?。
(5)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如图1、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在?▲?附近、反应时间应控制在?▲?。

参考答案:(每空2分,共14分)
⑴复合肥(或化肥)
⑵2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O?防止生成的K2FeO4发生分解
⑶增大K+浓度,促进K2FeO4晶体析出?
⑷11∶3?
⑸ 30%? 60min
30%? 60min
本题解析:略
本题难度:困难