| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《热化学方程式》高频考点强化练习(2019年最新版)(四)
参考答案:A 本题解析:葡萄糖的燃烧热是 -2804 kJ/mol即1mol葡萄糖完全燃烧生成6mol二氧化碳和6mol液态水时放出2804 kJ的热量,当生成1g液态水时放出热量为1g/18g/mol÷6mol×2804kJ=26.0kJ,答案选A。 本题难度:一般 4、简答题 (1)一定温度下,在恒容密闭容器中NO2与O2反应如下:4NO2(g)+O2(g)?2N2O5(g);若已知K350℃<K300℃,则该反应是______反应(填“吸热”或“放热”).反应达平衡后,若再通入一定量NO2,则平衡常数K将______,NO2的转化率______(填“增大”、“减小”或“不变”) |
参考答案:(1)已知K350℃<K300℃,说明升高温度,平衡常数减小,则说明升高温度,平衡向逆反应移动,应是正反应放热,平衡常数只受温度的影响,温度不变,则平衡常数不变,若再通入一定量NO2,虽然平衡向正反应方向移动,但转化的少,加入的多,转化率反而减小,
故答案为:放热;不变;变小;
(2)①平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,则反应2N2O5(g)?4NO2(g)+O2(g),
k=c4(NO2)c?(O2)c2(N2O5)?,故答案为:c4(NO2)c?(O2)c2(N2O5)?;?
②v=5.00mol/L-2.48mol/L1000s=0.00252?mol?L-1?s-1,故答案为:0.00252?mol?L-1?s-1;
③若每有1molN2O5分解,吸收QkJ的热量,该分解反应的热化学方程式为2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ?mol-1,故答案为:2N2O5(g)=4NO2(g)+O2(g)△H=+2QkJ?mol-1.
本题解析:
本题难度:一般
5、填空题 (10分)工业制氢气的一个重要反应是:CO(g)+H2O(g)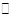 CO2(g)+H2(g)
CO2(g)+H2(g)
(1)已知在25。C时:
①C(石墨)+1/2O2(g)=CO(g) △H1=-111kJ·mol-1
②C(石墨)+O2(g)=CO2(g) △H2=-394kJ·mol-1
③H2(g)+1/2O2(g)=H2O(g) △H3=-242kJ·mol-1
则反应CO(g)+H2O(g) ="==" CO2(g)+H2(g)的反应热△H=___________.
(2)现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
①以下反应能说明CO(g)+H2O(g) CO2(g)+H2(g)达到平衡状态的是_________
CO2(g)+H2(g)达到平衡状态的是_________
A.容器中CO的含量保持不变
B.容器中CO2浓度与CO浓度相等
C.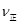 (CO)=
(CO)=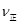 (H2O)
(H2O)
D.容器中混合气体的平均相对分子质量保持不变
②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率 (CO)=_____;
(CO)=_____;
③实验II条件下反应的平衡常数K=_____________(保留小数点后二位);
④实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是______;
⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时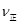 ___________
___________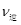 (填“>”或“<”),平 衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
(填“>”或“<”),平 衡向__________方向移动(填“正反应”、“逆反应”“不移动”)
参考答案:(1)-41kJ·mol-1(2分)(2)①A(1分) ②0.16mol·L-1·min-1 (2分)
③0.33(2分) ④a<b(1分) ⑤> 正反应(各1分)
本题解析:(1)②-①-③,整理可得:CO(g)+H2O(g) ="=" CO2(g)+H2(g)△H=-41kJ/mol;(2)①A.若容器中CO的含量保持不变,则其浓度不变,反应处于平衡状态,正确; B.容器中CO2浓度与CO浓度相等,反应可能处于平衡状态,也可能处于非平衡状态,因此不能作为判断反应处于平衡状态的标志,错误; C.无论反应是否达到平衡,都存在V(正)(CO)= V(正) (H2O) ,所以不能判断反应处于平衡状态,错误; D.由于容器的容积不变,气体的物质的量不变,所以无论反应进行到任何程度,容器中混合气体的平均相对分子质量都不变,因此不能判断反应处于平衡状态,错误;②实验I中,从反应开始到反应达到平衡时,CO的平均反应速率V(CO)=(1.6mol÷2L)÷5min=0.16mol/(L·min); ③实验II条件下反应的平衡常数K= ;④由于在其它条件不变时。增大反应物的浓度可以是其它反应物的转化率提高,而其本身的转化率降低,所以在实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是二者的物质的量的比小于方程式中的计量关系的比,即a<b;⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时由于Q=
;④由于在其它条件不变时。增大反应物的浓度可以是其它反应物的转化率提高,而其本身的转化率降低,所以在实验III中,若平衡时,CO的转化率大于水蒸气,则a,b必须满足的关系是二者的物质的量的比小于方程式中的计量关系的比,即a<b;⑤若在900℃时,实验II反应达到平衡后,向此容器中再加入1molCO、0.5mol H2O、0.2mol CO2、0.5mol H2,则此时由于Q= ,所以
,所以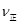 >
>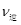 (填“”或“<”),平衡向向正反应方向移动。
(填“”或“<”),平衡向向正反应方向移动。
考点:考查热化学方程式的书写、可逆反应平衡状态的判断、化学反应速率、化学平衡产生的计算、物质转化率的大小比较和影响因素、化学反应进行的方向的判断的知识。
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《离子反应》.. | |