| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点归纳《热化学方程式》高频考点强化练习(2019年最新版)(八)
参考答案:D 本题解析:根据盖斯定律可知,①+②即得到C(s)+O2(g)=CO2(g),所以该反应的反应热为△H=—110.5 kJ/mol—283.0 kJ/mol=—393.5 kJ/mol,答案选D。 本题难度:一般 3、选择题 已知:C (s)+ O2(g)="CO(g)" H=" -110." 50KJ/mol |
参考答案:B
本题解析:根据盖斯定律,一式×2-二式:-110.50×2+393.5=+172.51 KJ/mol,选B。
考点:考查盖斯定律的应用。
本题难度:一般
4、选择题 相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g)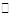 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
下列叙述正确的是
A.Q1>Q3>Q2 =78.8kJ
B.三个容器中反应的平衡常数均为K=2
C.甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D.若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)= mol/(L·min)
mol/(L·min)
参考答案:D
本题解析:综合考虑甲乙丙三个容器均容积恒定,则可达等效平衡,Ar不影响平衡状态,而甲从正反应开始,乙和丙同时从正逆反应方向开始,所以放出的热量Q1>Q2>Q3=78.8kJ;结合乙容器中放出的热量,计算得反应的SO2为0.8mol, 2SO2(g) + O2(g)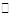 2SO3(g)
2SO3(g)
起始量(mol) 1.8 0.9 0.2
变化量(mol) 0.8 0.4 1.0
平衡量(mol) 1.0 0.5 1.0
由化学平衡常数的表达式:K=c2(SO3)/c(O2)×c2(SO2)=4,B项错误;达平衡时甲中SO2的转化率为50%,因为反应放热,当升高温度时,平衡向逆反应方向移动,其转化率减小。
考点:化学平衡状态、平衡常数、转化率、等效平衡。
本题难度:困难
5、填空题 20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:__________________________。 
参考答案:NO2(g)+CO(g)=CO2(g)+NO(g) △H=-234 kJ/mol
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《离子反应》.. | |