|
高考化学必考知识点《常见的化学电源》高频试题特训(2019年最新版)(二)
2019-05-30 03:23:56
【 大 中 小】
|
1、选择题 锂离子电池已经成为应用最广泛的可充电电池.某种锂离子电池的结构示意图:其中两极区间的隔膜只允许Li+通过.电池充电时的总反应化学方程式为:LiC002=Li1-xC002+xLi.关于该电池的推论错误的是( )
A.放电时,Li+主要从负极区通过隔膜移向正极区
B.放电时,负极反应xLi-xe-=xLi+
C.充电时,负极(C)上锂元素被氧化
D.充电时,有电能转化为化学能
| 
参考答案:A、放电时,是原电池的工作原理,在原电池中,阳离子Li+移向正极,故A正确;
B、放电时,是原电池的工作原理,原电池的负极发生失电子的氧化反应,即xLi-xe-=xLi+,故B正确;
C、充电时,属于电解池的工作原理,电解池的阴极发生得电子的还原反应,即锂元素被还原,故C错误;
D、充电时,属于电解池的工作原理,电解池是将电能转化为化学能的装置,故D正确.
故选C.
本题解析:
本题难度:简单
2、选择题 铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,电池总反应:Pb+PbO2+4H+ 2Pb2++2H2O。若充放电过程中电解质溶液的体积变化忽略不计,下列有关新型液流式铅酸蓄电池的说法正确的是 2Pb2++2H2O。若充放电过程中电解质溶液的体积变化忽略不计,下列有关新型液流式铅酸蓄电池的说法正确的是
A.充放电时,溶液中Pb2+浓度保持不变
B.充放电时,溶液的导电能力变化不大
C.充电时,阳极反应式为:Pb2++2H2O-2e-=PbO2+4H+
D.充电时,铅酸蓄电池的负极与外接电源的正极相连
参考答案:BC
本题解析:试题分析:新型液流式铅酸蓄电池以可溶的甲基磺酸铅为电解质,
电池总反应:Pb+PbO2+4H+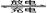 2Pb2++2H2O 2Pb2++2H2O
A.充放电时,溶液中Pb2+物质的量保持不变;
B.充放电时,溶液的导电能力变化不大;正确
C.充电时,阳极反应式为:Pb2++2H2O-2e-=PbO2+4H+正确;
D.充电时,铅酸蓄电池的负极与外接电源的负极相连。
故选BC。
点评:铅蓄电池的工作原理:铅酸蓄电池用填满海绵状铅的铅板作负极,填满二氧化铅的铅板作正极,并用1.28%的稀硫酸作电解质。在充电时,电能转化为化学能,放电时化学能又转化为电能。电池在放电时,金属铅是负极,发生氧化反应,被氧化为硫酸铅;二氧化铅是正极,发生还原反应,被还原为硫酸铅。电池在用直流电充电时,两极分别生成铅和二氧化铅。移去电源后,它又恢复到放电前的状态,组成化学电池。铅蓄电池是能反复充电、放电的电池,叫做二次电池。铅蓄电池在使用一段时间后要补充蒸馏水,使电解质保持含有22~28%的稀硫酸。
放电时,电极反应为:PbO2 + 4H+ + SO42- + 2e- = PbSO4 + 2H2O
负极反应: Pb + SO42- - 2e- = PbSO4? 总反应: PbO2 + Pb + 2H2SO4 ="==" 2PbSO4 + 2H2O (向右反应是放电,向左反应是充电)。
本题难度:简单
3、选择题 一种碳纳米管能够吸附氢气,用这种材料制备的二次电池原理如下图所示,该电池电解质为6 mol·L-1KOH溶液,下列说法中正确的是(?)

A.放电时K+移向负极
B.放电时电池负极的电极反应为:H2-2e-=2H+
C.放电时电池正极的电极反应为:NiO(OH)+H2O+e-=Ni(OH)2+OH-
D.该电池充电时将碳电极与电源的正极相连
参考答案:C
本题解析:该装置连接用电器时发生原电池反应,根据用电器中电子流向,确定碳电极作负极,H2发生氧化反应,负极反应式为H2+2OH--2e-=2H2O,则充电时碳电极与外电源的负极相连;镍电极作正极,发生还原反应,正极反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH-;电解质溶液中的阳离子移向正极,即K+移向镍电极(正极)。
本题难度:简单
4、填空题 (12分)生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式______________。
(2)根据等电子原理,写出CO分子的结构式________。
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9 。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,若Na2CO3溶液的浓度为2×10—4mo1/L,现将等体积的CaCl2溶液与Na2CO3溶液混合,则生成沉淀所需CaCl2溶液的最小浓度为______mo1/ L。
(4)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是________;甲醛分子的空间构型是_____,中心碳原子的轨道杂化类型为_____。1 mol甲醛分子中σ键的数目为________。
②甲醇可制作燃料电池,以KOH溶液作电解质,向两极分别充入甲醇和空气,工作过程中,负极反应方程式为:___________________。
③已知在常温常压下:
CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ? △H=" -556.0" kJ·mol-1
H2O(g)=H2O(l)? △H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式 。
参考答案:(1)1s22s22p63s23p63d104s2
(2)C≡O (3)5.6×10—5
(4)①甲醇分子之间形成氢键,平面三角形,sp2杂化,1.806×1024
②CH3OH-6e-+8OH-=CO32-+6H2O ③CH3OH(l)+3/2O2(g)=CO2(g) +2H2O(l)△H=-725.8kJ/mol
本题解析:(1)Zn的原子序数为30,关键是要注意3d轨道写在4s轨道的前面,电子排布式为1s22s22p63s23p63d104s2或[Ar]3d104s2,(2)依据等电子原理,可知CO与N2为等电子体,N2分子的结构式为:N≡N,互为等电子体分子的结构相似,可写出CO的结构式为C≡O,故答案为:C≡O;
(3)Na2CO3溶液的浓度为2×10-4mol/L,等体积混合后溶液中c(CO32-)=1/2×2×10-4mol/L=1×10-4mol/L,根据Ksp=c(CO32-)×c(Ca2+)=2.8×10-9可知,c(Ca2+)=2.8×10-5mol/L,原溶液CaCl2溶液的最小浓度为混合溶液中c(Ca2+)的2倍,故原溶液CaCl2溶液的最小浓度为2×2.8×10-5mol/L=5.6×10-5mol/L.
(4)①甲醇分子之间形成了分子间氢键,甲醛分子间只是分子间作用力,而没有形成氢键,故甲醇的沸
点高;甲醛为sp2杂化,不含孤电子对,分子的空间构型为平面三角形;1mol甲醛分子中含有2mol碳
氢δ键,1mol碳氧δ键,故含有δ键的物质的量为3mol,数目为1.806×1024个;②正极得到电子,
发生还原反应,同时因为在碱性条件下,则OH-参与反应,根据总方程式可知产物是CO32-和6H2O所以答案为:CH3OH-6e-+8OH-=CO32-+6H2O③根据盖斯定律得 :热方程式1+热化学方程式2×1/2+热化学方程式3×2 则答案为CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol
考点:考查共价键类型和热化学方程式书写等相关知识点
本题难度:困难
5、简答题 二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ、合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A、低温高压B、加催化剂C、体积不变充入N2 D、增加CO浓度E、分离出二甲醚
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
(1)该电池正极的电极反应式为______.电池在放电过程中,b对应的电极周围溶液的pH______.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.
①X、Y为石墨,a为2L 0.1mol/LKCl溶液,写出电解总反应的离子方程式:______.
②X、Y分别为铜、银,a为1L 0.2mol/LAgNO3溶液,写出Y电极反应式:______.
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图三计算,上述电解过程中消耗二甲醚的质量为______.
②若图三的B点pH=7,则滴定终点在______区间(填“AB”、“BC”或“CD”).
③C点溶液中各离子浓度大小关系是______.
参考答案:I.要提高CO的转化率,改变条件使反应向正反应方向移动,可以通过改变温度、压强、浓度使平衡向正反应方向移动,
A、低温高压平衡向正反应方向移动,所以能提高CO的转化率,故正确;
B、加催化剂只能改变反应速率,不能改变平衡移动方向,故错误;
C、体积不变充入N2,反应物和生成物浓度不变,则化学反应不移动,所以不能提高CO的转化率,故错误;
D.增加CO浓度平衡向正反应方向移动,但CO的转化率减小,故错误;
E、分离出二甲醚,二甲醚浓度减小,平衡向正反应方向移动,则能提高CO的转化率,故正确;
故选AE;
II.(1)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O;
电池在放电过程中,b对应的电极上二甲醚失电子生成氢离子,导致氢离子浓度增大,则溶液的pH减小;
故答案为:O2+4e-+4H+=2H2O;减小;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电,所以电池反应式为:2Cl-+2H2O电解.2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O电解.2OH-+H2↑+Cl2↑;
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应,电极反应式为Ag-e-=Ag+,
故答案为:Ag-e-=Ag+;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O电解.2OH-+H2↑+Cl2↑知,生成0.2mol氢氧根离子转移电子的物质的量=0.2mol2×2=0.2mol,二甲醚燃料电池的总反应方程式是CH3OCH3+3O2=2CO2+3H2O,二甲醚转化为CO2,生成1mol二甲醚转移电子数=2×[4-(-2)]=12mol,因此当转移0.2mol电子时消耗二甲醚的质量=0.2mol12×46g/mol=0.77g,
故答案为:0.77g;
②滴定终点二者恰好反应生成CH3COOK,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的pH=7时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB;
③C点溶液呈酸性则c(H+)>c(OH-),结合电荷守恒c(K+)+c(H+)=c(CH3COO-)+c(OH-),得到c(CH3COO-)>c(K+),所以溶液中离子浓度大小顺序是:c(CH3COO-)>c(K+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-).
本题解析:
本题难度:一般
| 