1、简答题 二甲醚(CH3OCH3)被称为21世纪的清洁、高效能源.
Ⅰ、合成二甲醚反应一:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-247kJ/mol
一定条件下该反应在密闭容器中达到平衡后,要提高CO的转化率,可以采取的措施是______.
A、低温高压B、加催化剂C、体积不变充入N2 D、增加CO浓度E、分离出二甲醚
Ⅱ、二甲醚燃料电池的工作原理如图一所示.
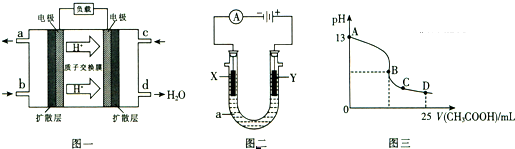
(1)该电池正极的电极反应式为______.电池在放电过程中,b对应的电极周围溶液的pH______.(填“增大”、“减小”或“不变”)
(2)以上述电池为电源,通过导线与图二电解池相连.
①X、Y为石墨,a为2L 0.1mol/LKCl溶液,写出电解总反应的离子方程式:______.
②X、Y分别为铜、银,a为1L 0.2mol/LAgNO3溶液,写出Y电极反应式:______.
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到图三(不考虑能量损失和气体溶于水,溶液体积变化忽略不计).
①结合图三计算,上述电解过程中消耗二甲醚的质量为______.
②若图三的B点pH=7,则滴定终点在______区间(填“AB”、“BC”或“CD”).
③C点溶液中各离子浓度大小关系是______.
参考答案:I.要提高CO的转化率,改变条件使反应向正反应方向移动,可以通过改变温度、压强、浓度使平衡向正反应方向移动,
A、低温高压平衡向正反应方向移动,所以能提高CO的转化率,故正确;
B、加催化剂只能改变反应速率,不能改变平衡移动方向,故错误;
C、体积不变充入N2,反应物和生成物浓度不变,则化学反应不移动,所以不能提高CO的转化率,故错误;
D.增加CO浓度平衡向正反应方向移动,但CO的转化率减小,故错误;
E、分离出二甲醚,二甲醚浓度减小,平衡向正反应方向移动,则能提高CO的转化率,故正确;
故选AE;
II.(1)根据氢离子移动方向知,左边电极是负极,通入燃料二甲醚,右边电极是正极,通入氧化剂氧气,该燃料电池中,正极上氧气得电子和氢离子反应生成水,电极反应式为O2+4e-+4H+=2H2O;
电池在放电过程中,b对应的电极上二甲醚失电子生成氢离子,导致氢离子浓度增大,则溶液的pH减小;
故答案为:O2+4e-+4H+=2H2O;减小;
(2)①X、Y为石墨,放电时,阳极上氢氧根离子放电、阴极上氢离子放电,所以电池反应式为:2Cl-+2H2O电解.2OH-+H2↑+Cl2↑,故答案为:2Cl-+2H2O电解.2OH-+H2↑+Cl2↑;
②X、Y分别为铜、银,Y是阳极,阳极上银失电子发生氧化反应,电极反应式为Ag-e-=Ag+,
故答案为:Ag-e-=Ag+;
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后溶液,滴加0.4mol/L醋酸得到图三,
①根据图知,KOH溶液的pH=13,常温下,KOH的浓度是0.1mol/L,则n(KOH)=0.1mol/L×2L=0.2mol,根据2Cl-+2H2O电解.2OH-+H2↑+Cl2↑知,生成0.2mol氢氧根离子转移电子的物质的量=0.2mol2×2=0.2mol,二甲醚燃料电池的总反应方程式是CH3OCH3+3O2=2CO2+3H2O,二甲醚转化为CO2,生成1mol二甲醚转移电子数=2×[4-(-2)]=12mol,因此当转移0.2mol电子时消耗二甲醚的质量=0.2mol12×46g/mol=0.77g,
故答案为:0.77g;
②滴定终点二者恰好反应生成CH3COOK,KOH的浓度是醋酸的一半,则恰好中和时需要酸的体积等于KOH体积的一半,醋酸钾为强碱弱酸盐,其溶液呈碱性,当溶液的pH=7时,醋酸稍微过量,所以醋酸体积大于KOH体积的一半,所以滴定终点为AB段,故答案为:AB;
③C点溶液呈酸性则c(H+)>c(OH-),结合电荷守恒c(K+)+c(H+)=c(CH3COO-)+c(OH-),得到c(CH3COO-)>c(K+),所以溶液中离子浓度大小顺序是:c(CH3COO-)>c(K+)>c(H+)>c(OH-),故答案为:c(CH3COO-)>c(K+)>c(H+)>c(OH-).
本题解析:
本题难度:一般
2、选择题 一种新型燃料电池,一极通入空气,另一极通入C4H10气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2—。下列对该燃料电池说法正确的是(?)
A.在熔融电解质中,O2—由负极向正极
B.电池工作时,消耗1mol C4H10最多转移16mol e—
C.通入空气的一极是正极,电极反应式为:O2+4e—=2O2—
D.通入丁烷的一极为正极;电极反应式为:C4H10+13O2—+26e—=4CO2+5H2O
参考答案:C
本题解析:丁烷是可燃性气体,在负价失去电子被氧化,电子通过导线传递到正极上,然后氧气在正极上得到电子被还原,由于电解质是熔融的盐,所以氧气的还原产物是O2—,A不正确。丁烷中碳的化合价是-2.5价,氧化产物是CO2,碳的化合价是+价,所以1mol丁烷反应转移的电子是4×(4+2.5)mol=26mol,B不正确。负价和正极的反应式分别是2C4H10+26O2—+52e—=8CO2+10H2O、13O2+52e—=26O2—,所以正确的答案是C。
本题难度:简单
3、选择题 镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:
Ni(OH)2 + M =" NiOOH" + MH
已知:6NiOOH + NH3 + H2O + OH-="6" Ni(OH)2 + NO2-
下列说法正确的是
NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH-
充电过程中OH-离子从阳极向阴极迁移
充电过程中阴极的电极反应式:H2O + M + e-=" MH" + OH-,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
参考答案:A
本题解析:B.充电过程中阴离子OH-离子向阳极迁移,不正确;C. H2O + M + e-=" MH" + OH-,H2O中的H电离成H+得到电子被还原;D. 由已知可知NiOOH 与NH3发生反应。A为阿伏加德罗常数的值来表示微粒数目。
本题难度:一般
4、填空题 (10分)(1)处理含CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S。
(已知:①CO(g)+ 1/2O2(g)=CO2(g) △H=-283.0KJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296.0KJ·mol-1 )
此反应的热化学方程式是 。
(2)硫—碘循环分解水制氢,主要涉及下列反应:
I SO2+2H2O+I2===H2SO4+2HI II 2HI H2+I2
H2+I2
III 2H2SO4====2SO2+O2+2H2O
分析上述反应,下列判断正确的是 。、
a.反应III易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1 molH2
(3)实验室用Zn和稀硫酸制取H2,若加入少量下列试剂中的 ,产生H2的速率将增大。
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(4)以丙烷(C3H8)为燃料制作新型燃料电池,电池的正极通人O2和CO2,负极通人丙烷.电解质是熔融碳酸盐。电池反应方程式为 。
(5)冶炼铜的反应为8CuFeS2+21O2=8Cu+4FeO+2Fe2O3+16SO2
上述冶炼过程产生大量SO2。下列处理SO2的方案中合理的是 (填代号)。
a.高空排放 b.用于制备硫酸 c.用纯碱溶液吸收制Na2SO3 d.用浓硫酸吸收
参考答案:(10分,每空2分)
(1)2CO(g)+SO2(g)=S(s)+2CO2(g) △H1=-270KJ·mol-1
(2)c (3)b (4)C3H8+5O2=3CO2+4H2O (5)b,c
本题解析:(1)CO、SO2烟道气污染的一种方法是将其在催化剂作用下转化为单质S的化学方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g),所以,其反应的热化学方程式的反应热为:①×2+②=-270,即热化学方程式为:2CO(g)+SO2(g)=S(s)+2CO2(g) △H1=-270KJ·mol-1
(2)I、II、III的总方程式为:2H2O ===== 2H2 + O2;所以正确答案只有c;
(3)正确答案为b,Zn与CuSO4溶液反应置换出Cu从而形成原电池加快反应速率。而a.NaNO3相当于溶液中存在HNO3,则无H2生成;加入c.Na2SO4不影响反应速率;加入d.NaHSO3会与H2SO4反应使溶液中H+浓度降低反应速率减小。
(4)燃料电池的总反应方程式相当于燃料的直接燃烧
(5)高空排放明显会污染环境不可行;二氧化硫不能与浓硫酸反应
本题难度:困难
5、选择题 已知LiFePO4新型锂离子动力电池放电时总反应式为FePO4+Li═LiFePO4,则下列有关说法不正确的是( )
A.放电时,正极反应为FePO4+Li++e-═LiFePO4
B.充电时,动力电池上标注“+”的电极反应与外接电源的正极相连
C.放电时,电池内部Li+向负极移动
D.充电时,阴极上Li+得到电子被还原
参考答案:放电时,正极上FePO4得电子发生还原反应,电极反应式为:FePO4+Li++e-═LiFePO4,故A正确;
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连,发生氧化反应:LiFePO4-e-=FePO4+Li+,故B正确;
C.放电时,电池内部Li+向正极移动,故C错误;
D.充电时,阴极上Li+得到电子被还原,发生还原反应,故D正确;
故选C.
本题解析:
本题难度:一般