1、选择题 下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
B.常温下,c(NH4+)相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3) <c(Na2CO3)
D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液PH=2,则a:b=2:9
参考答案:B
本题解析:试题分析:在稀溶液中c(H+)与c(OH-)的乘积是个定值,不可能同时下降或升高,A项错误;Fe2+的水解抑制NH4+的水解,CO32-的水解促进NH4+的水解,所以等浓度的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液c(NH4+)②>①>④>③,因此,c(NH4+)相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、?④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③,B项正确;根据越弱越水解可知浓度相同的CH3COONa、NaHCO3和Na2CO3三种溶液的pH为:Na2CO3>NaHCO3>CH3COONa,因此pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)>c(NaHCO3)>c(Na2CO3),C项错误;pH=11的NaOH溶液c(OH-)=10-2mol/L,pH=1的稀硫酸c(H+)=10-1 mol/L,混合后pH=2则有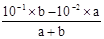 =10-2,则a:b=9:2,D项错误。答案选B。
=10-2,则a:b=9:2,D项错误。答案选B。
考点:水的电离和盐类的水解
点评:本题综合性强,难度大,主要考查学生对知识的分析能力和运用能力。
本题难度:简单
2、选择题 实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应的下列说法正确的是
A.NaNO2是氧化剂
B.每生成1 mol N2转移的电子的物质的量为6 mol
C.NH4Cl中的氮元素被还原
D.N2既是氧化剂,又是还原剂
参考答案:A
本题解析:
A.NaNO2是氧化剂,正确,+3价的N化合价降低。
B.每生成1 mol N2转移的电子的物质的量为3mol
C.NH4Cl中的氮元素被氧化,—3价的N 化合价升高。
D.N2既是氧化产物,又是还原产物。
本题难度:困难
3、选择题 在由水电离出来c(H+)=1×10-12?mol·L-1的无色溶液中,下列离子可能大量共存的是
A.NH4+、Ba2+、NO3-、CO32-
B.Na+、OH-、SO42-、MnO4-
C.Na+、Fe3+、Cl-、AlO2-
D.K+、Mg2+、NO3-、SO42-
参考答案:D
本题解析:由水电离出来c(H+)=1×10-12 mol·L-1的溶液可能显酸性,也可能显碱性。
A?氨根离子和氢氧根离子不能共存,碳酸跟离子和氢离子不能共存,所以在酸性和碱性环境中都不可能共存
B?高锰酸根离子是紫色的,不是无色溶液
C 三价铁离子是黄色的,不是无色溶液
D 是无色溶液,在碱性环境中不能共存,但在酸性环境中可大量共存,故选D
本题难度:一般
4、填空题 (8分)(一)下列各组离子在指定溶液中一定能大量共存的是___________________。
①无色溶液中:K+、Na+、MnO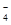 、SO
、SO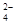
②甲基橙呈黄色的溶液中:I-、Cl-、NO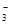 、Na+
、Na+
③石蕊呈蓝色的溶液中:Na+、AlO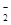 、NO
、NO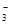 、HCO
、HCO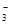
④在pH=1的溶液中:Fe2+、NO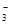 、SO
、SO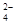 、Na+
、Na+
⑤在pH=0的溶液中:Na+、NO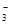 、SO
、SO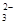 、K+
、K+
⑥在pH=12的溶液中:K+、Cl-、HCO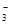 、Na+
、Na+
⑦含大量OH-的溶液中:CO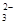 、Cl-、F-、K+
、Cl-、F-、K+
⑧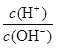 =1012的溶液中:NH
=1012的溶液中:NH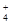 、Al3+、NO
、Al3+、NO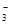 、Cl-
、Cl-
⑨加入Al能放出H2的溶液中:Cl-、HCO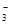 、SO
、SO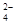 、NH
、NH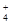
⑩由水电离出的c(OH-)=10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO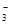
?c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO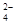 、SCN-
、SCN-
?含大量Al3+的溶液中:K+、Na+、NO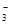 、ClO-
、ClO-
(二)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为____________。
(2)写出该反应的化学方程式_____________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是_______________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________________________(填化学式)。
参考答案:(一)⑦⑧ (2分)
(二)(1)1∶2 (1分); (2)3NF3+5H2O===2NO+HNO3+9HF (2分)
(3)产生红棕色气体、产生刺激性气味气体、产生白雾 (2分) (4)NaNO3
本题解析:(一)①MnO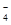 是紫色的,在无色溶液中不能大量存在,错误;②使甲基橙呈黄色的溶液可能是酸性溶液,在酸性溶液中:I-、NO
是紫色的,在无色溶液中不能大量存在,错误;②使甲基橙呈黄色的溶液可能是酸性溶液,在酸性溶液中:I-、NO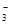 会发生氧化还原反应而不能大量共存,错误;③使石蕊呈蓝色的溶液是碱性溶液,在碱性溶液中:OH-和 HCO
会发生氧化还原反应而不能大量共存,错误;③使石蕊呈蓝色的溶液是碱性溶液,在碱性溶液中:OH-和 HCO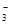 会放出反应而不能大量存在,错误;④在pH=1的溶液中:H+和Fe2+、NO
会放出反应而不能大量存在,错误;④在pH=1的溶液中:H+和Fe2+、NO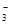 会发生氧化还原反应而不能大量存在,错误;⑤ pH=0的溶液是强酸性溶液,在该溶液中: NO
会发生氧化还原反应而不能大量存在,错误;⑤ pH=0的溶液是强酸性溶液,在该溶液中: NO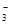 、SO
、SO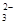 、和H+会发生氧化还原反应而不能大量共存,错误;⑥ pH=12的溶液是强碱性溶液,在该溶液中OH-、HCO
、和H+会发生氧化还原反应而不能大量共存,错误;⑥ pH=12的溶液是强碱性溶液,在该溶液中OH-、HCO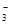 会发生反应而不能大量共存,错误;⑦含大量OH-的溶液中:CO
会发生反应而不能大量共存,错误;⑦含大量OH-的溶液中:CO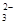 、Cl-、F-、K+不会发生任何反应,可以大量共存,正确;⑧
、Cl-、F-、K+不会发生任何反应,可以大量共存,正确;⑧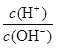 =1012的溶液是酸性溶液,在该溶液中:NH
=1012的溶液是酸性溶液,在该溶液中:NH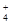 、Al3+、NO
、Al3+、NO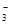 、Cl-+不会发生任何反应,可以大量共存,正确;⑨加入Al能放出H2的溶液可能呈酸性也可能呈碱性,在酸性溶液中: HCO
、Cl-+不会发生任何反应,可以大量共存,正确;⑨加入Al能放出H2的溶液可能呈酸性也可能呈碱性,在酸性溶液中: HCO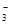 、会发生反应而不能大量存在;在碱性溶液中HCO
、会发生反应而不能大量存在;在碱性溶液中HCO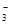 、NH
、NH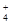 会发生离子反应而不能大量共存,错误;⑩由水电离出的c(OH-)=10-14 mol/L的溶液可能呈酸性也可能呈碱性,无论是酸性还是碱性溶液中HCO
会发生离子反应而不能大量共存,错误;⑩由水电离出的c(OH-)=10-14 mol/L的溶液可能呈酸性也可能呈碱性,无论是酸性还是碱性溶液中HCO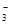 都会发生离子反应而不能大量存在,错误;?c(Fe3+)=0.1 mol/L的溶液中:Fe3+与SCN-会发生络合反应而不能大量存在,错误;?含大量Al3+的溶液是酸性溶液,在酸性溶液中: ClO-会发生离子反应产生HClO而不能大量存在,错误。故各组离子在指定溶液中一定能大量共存的是⑦⑧;(二)三氟化氮(NF3)和水蒸气反应的化学方程式是:3NF3+5H2O="9" HF+2NO+HNO3,反应过程中,被氧化的N元素与被还原的N元素原子的物质的量之比为1:2;NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现反应产生的NO被空气氧化为NO2,而使气体呈红棕色,而且硝酸在空气中形成酸雾,HF是无色有刺激性气味的气体,故选项是产生红棕色气体、产生刺激性气味气体、产生白雾;(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,NO2发生反应产生其产物除NaNO2、NaNO3、HF与碱反应产生NaF。所以其产物除NaNO2、NaF、H2O外,还肯定有NaNO3。
都会发生离子反应而不能大量存在,错误;?c(Fe3+)=0.1 mol/L的溶液中:Fe3+与SCN-会发生络合反应而不能大量存在,错误;?含大量Al3+的溶液是酸性溶液,在酸性溶液中: ClO-会发生离子反应产生HClO而不能大量存在,错误。故各组离子在指定溶液中一定能大量共存的是⑦⑧;(二)三氟化氮(NF3)和水蒸气反应的化学方程式是:3NF3+5H2O="9" HF+2NO+HNO3,反应过程中,被氧化的N元素与被还原的N元素原子的物质的量之比为1:2;NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现反应产生的NO被空气氧化为NO2,而使气体呈红棕色,而且硝酸在空气中形成酸雾,HF是无色有刺激性气味的气体,故选项是产生红棕色气体、产生刺激性气味气体、产生白雾;(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,NO2发生反应产生其产物除NaNO2、NaNO3、HF与碱反应产生NaF。所以其产物除NaNO2、NaF、H2O外,还肯定有NaNO3。
考点:考查离子的检验与共存、氧化还原反应的计算、物质的检验及产物的判断的知识。
本题难度:一般
5、选择题 室温时,下列溶液混合后,pH大于7的是
A.0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合
B.0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合
C.pH=3的硫酸和pH=11的氨水等体积混合
D.pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合
参考答案:C
本题解析:试题分析:A中二者恰好反应,溶液显中性;B中恰好反应时,生成CO2,溶于水显酸性;C中氨水是弱碱,氨水过量,溶液显碱性;D中醋酸是弱酸,醋酸过量,溶液显酸性,答案选C。
考点:考查酸碱中和后溶液酸碱性的判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理能力和灵活应变能力。该题的关键是准确判断出酸碱的过量问题,然后再 依据题意灵活运用即可。
本题难度:简单