1、选择题 下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c(NH4+)、c(H+)均下降
B.常温下,c(NH4+)相等的①(NH4)2SO4②(NH4)2Fe(SO4)2③NH4Cl④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③
C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3) <c(Na2CO3)
D.某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液aL与pH=1的稀硫酸bL混合,若所得混合液PH=2,则a:b=2:9
2、选择题 实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl===NaCl+N2↑+2H2O。关于该反应的下列说法正确的是
A.NaNO2是氧化剂
B.每生成1 mol N2转移的电子的物质的量为6 mol
C.NH4Cl中的氮元素被还原
D.N2既是氧化剂,又是还原剂
3、选择题 在由水电离出来c(H+)=1×10-12?mol·L-1的无色溶液中,下列离子可能大量共存的是
A.NH4+、Ba2+、NO3-、CO32-
B.Na+、OH-、SO42-、MnO4-
C.Na+、Fe3+、Cl-、AlO2-
D.K+、Mg2+、NO3-、SO42-
4、填空题 (8分)(一)下列各组离子在指定溶液中一定能大量共存的是___________________。
①无色溶液中:K+、Na+、MnO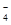 、SO
、SO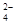
②甲基橙呈黄色的溶液中:I-、Cl-、NO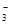 、Na+
、Na+
③石蕊呈蓝色的溶液中:Na+、AlO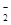 、NO
、NO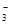 、HCO
、HCO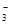
④在pH=1的溶液中:Fe2+、NO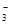 、SO
、SO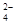 、Na+
、Na+
⑤在pH=0的溶液中:Na+、NO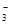 、SO
、SO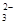 、K+
、K+
⑥在pH=12的溶液中:K+、Cl-、HCO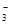 、Na+
、Na+
⑦含大量OH-的溶液中:CO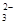 、Cl-、F-、K+
、Cl-、F-、K+
⑧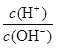 =1012的溶液中:NH
=1012的溶液中:NH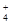 、Al3+、NO
、Al3+、NO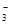 、Cl-
、Cl-
⑨加入Al能放出H2的溶液中:Cl-、HCO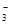 、SO
、SO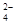 、NH
、NH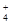
⑩由水电离出的c(OH-)=10-14 mol/L的溶液中:Ca2+、K+、Cl-、HCO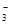
?c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO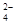 、SCN-
、SCN-
?含大量Al3+的溶液中:K+、Na+、NO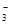 、ClO-
、ClO-
(二)三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,被氧化与被还原的元素原子的物质的量之比为____________。
(2)写出该反应的化学方程式_____________________________________。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是_______________________________________。
(4)一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有______________________________(填化学式)。
5、选择题 室温时,下列溶液混合后,pH大于7的是
A.0.1 mol·L-1的盐酸和pH=13的氢氧化钡溶液等体积混合
B.0.1 mol·L-1的NaHCO3溶液和pH=1的盐酸等体积混合
C.pH=3的硫酸和pH=11的氨水等体积混合
D.pH=1的醋酸和0.1mol/L的氢氧化钠溶液等体积混合