1、选择题 随着环保理念深入人心,空气质量日益受到人们的关注.下列物质中,未计入监测空气污染指数项目的是
A.氮气
B.二氧化硫
C.一氧化碳
D.可吸入颗粒物
参考答案:A
本题解析:分析:空气质量日报的监测项目中包含有毒、有害气体和可吸入颗粒物,据此分析判断.
解答:A、氮气是空气的主要成分,无毒,所以不属于空气污染物,故A正确;
B、二氧化硫是有毒气体,是形成酸雨的主要物质,属于空气污染物,故B错误;
C、一氧化碳是有毒气体,属于空气污染物,故C错误;
D、可吸入颗粒物属于空气污染物,故D错误;
故选A.
点评:本题考查了污染空气的主要物质,难度不大,明确“有毒、有害及可吸入颗粒物”是空气的主要污染物即可分析解答.
本题难度:简单
2、选择题 已知丙烷的二氯代物有四种异构体,则其六氯代物的异构体数目为( )
A.两种
B.三种
C.四种
D.五种
参考答案:C
本题解析:试题分析:采用换元法,将氯原子代替氢原子,氢原子代替氯原子,从二氯代物有四种同分异构体,就可得到六氯代物也有四种同分异构体,所以答案选C。
考点:考查同分异构体的判断
点评:该题是中等难度的试题,试题注重基础,侧重对学生能力的培。该题的关键是学会换位思考,有利于培养学生的发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:简单
3、选择题 向12mol/L的HNO3溶液100mL中投入一小块铜片,经完全反应后,放出气体6.72L(不考虑NO2转化为N2O4),并测得溶液的c(H+)=1mol/L(设溶液体积不变).则投入铜片的质量为
A.9.6g
B.25.6g
C.28.8g
D.无法计算
参考答案:B
本题解析:分析:n(HNO3)=0.1L×12mol/L=1.2mol,n(NO)+n(NO2)= =0.3mol,根据N元素守恒可计算反应溶液中n(NO3-),利用溶液电荷守恒可计算Cu的物质的量,进而计算铜片的质量.
=0.3mol,根据N元素守恒可计算反应溶液中n(NO3-),利用溶液电荷守恒可计算Cu的物质的量,进而计算铜片的质量.
解答:n(HNO3)=0.1L×12mol/L=1.2mol,
浓硝酸与铜反应生成NO2,随着反应的进行,硝酸的浓度逐渐降低,则生成NO,
则n(NO)+n(NO2)= =0.3mol,
=0.3mol,
由N元素守恒可知,反应后溶液中n(NO3-)=1.2mol-0.3mol=0.9mol,
c(H+)=1mol/L,则n(H+)=0.1L×1mol/L=0.1mol,
硝酸过量,则铜完全反应,反应后溶液中存在H+、Cu2+、NO3-等离子,
根据溶液电荷守恒可得:n(H+)+2n(Cu2+)=n(NO3-),
则n(Cu2+)=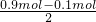 =0.4mol,
=0.4mol,
m(Cu)=0.4mol×64g/mol=25.6g,
故选B.
点评:本题考查氧化还原反应的计算,题目难度不大,注意从质量守恒、电荷守恒的角度解答该题.
本题难度:困难
4、选择题 某些金属卤化物可跟其卤素反应,如KI+I2?KI3下列推断错误的是
A.溶液中存在如下平衡:?
B.在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀
C.KI3溶液可用于检验淀粉的存在
D.配制碘水时,加入KI可增大I2的溶解度
参考答案:B
本题解析:分析:根据KI+I2?KI3可知,在KI3溶液中存在I3-、I-、I2等粒子,结合对应的物质的性质以及平衡移动的影响因素解答该题.
解答:A.由反应KI+I2?KI3可知,溶液中存在平衡I3-?I-+I2,故A正确;
B.在KI3溶液中存在I-,加入AgNO3溶液,会析出AgI沉淀,故B错误;
C.在KI3溶液中存在I2,可用于检验淀粉的存在,故C正确;
D.从平衡移动的角度分析,对于平衡I3-?I-+I2,增加I-浓度,平衡向生成I3-的方向移动,可增大I2的溶解度,故D正确.
故选B.
点评:本题考查氯溴碘及其化合物的综合应用,题目难度中等,本题注意根据可逆反应的特点解答该题.
本题难度:一般
5、选择题 下列叙述正确的是
A.乙烯、苯、乙酸分子中的所有原子都在同一平面上
B.蛋白质、淀粉、纤维素和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色
参考答案:C
本题解析:试题分析:A选项,乙烯、苯分子中的所有原子都在同一平面上,乙酸中的甲基呈四面体结构,故所有原子一定不会在同一平面上,A错误;油脂不属于高分子化合物,B错误;C选项中均为取代反应,正确;甲苯不能使溴的四氯化碳溶液褪色,D错误。
考点:化学实验
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验、化学仪器的相关知识的积累。
本题难度:一般