| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《化学平衡常数》考点巩固(2019年最新版)(六)
A.10min内甲容器中反应的平均速率v(A)=0.025mol/(L?min) B.由图可知:T1<T2,且该反应为放热反应 C.x=1,若平衡时保持温度不变,改变容器体积平衡不移动 D.T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25% |

参考答案:BC
本题解析:
本题难度:一般
3、选择题 下列各表述与示意图一致的是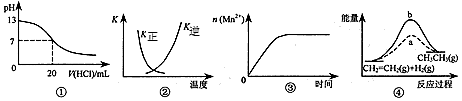
[? ]
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 B.图②中曲线表示反应2SO2(g) + O2(g)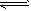 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)→CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
参考答案:B
本题解析:
本题难度:一般
4、填空题 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)写出CO燃烧的热化学方程式___________________;
(2)写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________;
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃); 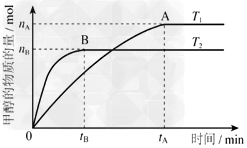
①温度升高该反应的平衡常数___________?(增大、减小、不变)
②B过程用H2表示该反应的化学反应速率是________mol·L-1·min-1
(4)在直接以甲醇为燃料的电池中,电解质溶液为碱性,总反应为:CH3OH+3/2O2+2OH-==CO32-+3H2O,负极的反应式为______________。
参考答案:(1)2CO(g) + O2(g) = 2CO2(g) △H=-566kJ·mol-1
(2)CH3OH(l)+ O2(g)=CO(g)+2H2O(l)?△H=-443.5kJ·mol-1
(3)减小;3n(B)/[2t(B)]?
(4)CH3OH-6e-+8OH-==CO32-+6H2O
本题解析:
本题难度:一般
5、填空题 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和反应②,用CH4和H2O为原料来制备甲醇(CH3OH).
①CH4(g)+H2O(g)?CO(g)+3H2(g)△H1
②CO(g)+2H2(g)?CH3OH(g)△H2
将0.20mol?CH4和0.30mol?H2O(g)通入容积为10L的密闭容器中,在一定条件下发生①反应,达到平衡时,CH4的转化率与温度、压强的关系如图.
(1)温度不变,缩小体积,增大压强,①的反应速率______(填“增大”、“减小”或“不变”),平衡向______方向移动.
(2)反应①的△H1______0(填“<”、“=”或“>”).
(3)如果反应①达到平衡时所用的时间为2min,求CH4的反应速率及化学平衡常数的值.(写出计算过程).
(4)在100℃压强为0.1MPa条件下,将a?mol?CO与?3a?mol?H2的混合气体在催化剂作用下进行②反应,生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填入剩余的实验条件数据.
| 实验编号 | T(℃) | n?(CO)/n(H2) | P(MPa) I 150
0.1 II 5 III 350 5 |

参考答案:(1)温度不变,缩小体积增大压强,反应速率增大,平衡向气体体积减小的方向移动,即反应①向逆反应移动,
故答案为:增大;逆反应;
(2)采取控制变量法分析,由图可知压强相同时,到达平衡时,温度越高CH4的转化率越大,升高温度平衡向正反应移动,故正反应为吸热反应,即△H>0,
故答案为:>;
(3)由100℃平衡CH4的转化率为0.5可知,消耗CH4为0.2mol×0.5=0.1mol,平衡时甲烷的浓度变化量为0.1mol10L=0.01mol/L,故v(CH4)=0.01mol/L2min=0.005mol/(L?min);
平衡时甲烷的浓度变化量为0.1mol10L=0.01mol/L,则:
?CH4(g)+H2O(g)?CO(g)+3H2(g)
开始(mol/L):0.02?0.03?0? 0
变化(mol/L):0.01? 0.01? 0.01? 0.03
平衡(mol/L):0.01? 0.02? 0.01? 0.03
故100℃时平衡常数k=0.033?×0.010.02×0.01=1.35×10-3,
答:CH4的反应速率为0.005mol/(L?min);100℃时平衡常数化学平衡常数的值为1.35×10-3;
(4)通过“控制变量法”探究外界条件对化学平衡的影响,探究的前提只能是改变一个条件,而其它条件不变,由此可得:Ⅱ中温度为150℃,n?(CO)/n(H2)为13,Ⅲ中n?(CO)/n(H2)为13,
故答案为:实验编号T(℃)n?(CO)/n(H2)P(MPa)III15013III13.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《有机物燃烧.. | |