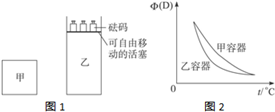
1、填空题 已知:2NO2(g)?N2O4(g)△H<O.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
(1)a、b、c、d四个点中,化学反应处于平衡状态的是______点.
(2)25min时,增加了______(填物质的化学式)______mol,平衡向生成______(填“NO2、N2O4”)反应方向移动.
(3)a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是______(填字母).
2、选择题 已知448℃时反应H2(g)+I2(g)?2HI(g)的平衡常数是49,则HI(g)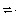 1/2H2(g)+1/2I2(g)?,在该温度下的平衡常数是( )
1/2H2(g)+1/2I2(g)?,在该温度下的平衡常数是( )
A.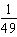
B.2401
C.7
D.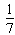
3、填空题 下图为常用笔记本电脑所用甲醇质子交换膜燃料电池的结构示意图。电池总反应为2CH3OH+3O2
2CO2+4H2O。(已知甲醇的标准燃烧热为-725.76kJ·mol-1)
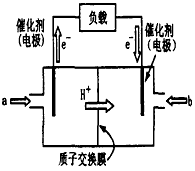
(1)该装置中______(填a或b)为电池的负极,其电极反应为____________。
(2)已知任何反应都具有一定的可逆性。该甲醇质子交换膜燃料电池在实际工作中,各反应物、生成物均以气态的形式存在且反应也具有一定可逆性,即其反应原理可表示为2CH3OH(g)+3O2(g)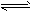
2CO2(g)+4H2O(g),试写出该条件下反应的平衡常数表达式K=________;在电脑的使用过程中,电池的温度往往因为各种原因会升高,试判断温度升高时该反应的平衡常K将________(填增大、减小、不变),其反应的正反应速率将________(填增大、减小、不变);逆反应速率将________(填增大、减小、不变);温度升高________(填有利或不利于)电池将化学能转化为电能。
(3)又已知在该条件下H2O(l)=H2O(g) ΔH=+akJ·mol-1;CH3OH(l)= CH3OH(g) ΔH=+b kJ·mol-1。若常温下一定量的甲醇完全燃烧生成液态水释放出了1451.52 kJ的能量,则等质量的甲醇利用图示装置理论上可提供________mol电子的电量。
4、选择题 下列说法中,正确的是
[? ]
A.Kw随温度、浓度的改变而改变
B.凡是能自发进行的化学反应,一定是△H<0、△S>0
C.对已达到化学平衡的反应,改变压强,平衡常数(K)一定改变
D.Ksp只与难溶电解质的性质和温度有关,而与溶液中的离子浓度无关
5、选择题 当温度不变的情况下,有反应:2A(g)+2B(g)

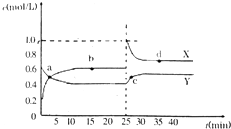
C(g)+3D(g),△H<0.现将2mol?A和2mol?B充入体积为V的甲容器,将2mol?C和6mol?D充入乙容器并使乙容器在反应开始前体积为2V(如图1).关于两容器中反应的说法正确的是( )
A.甲容器中的反应先达到化学平衡状态
B.两容器中的反应均达平衡时,平衡混合物中各组分的体积百分组成相同,混合气体的平均相对分子质量也相同
C.两容器达平衡后升高相同的温度,两容器中物质D的体积分数随温度变化如图2所示
D.在甲容器中再充入2molA和2molB,平衡后甲容器中物质C的浓度是乙容器中物质C的浓度的3倍