|
|
|
高考化学必考知识点《离子方程式的书写及正误判断》高频考点预测(2019年最新版)(八)
2019-05-30 03:32:43
【 大 中 小】
|
1、填空题 (12分)现有下列七种物质:
①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2⑥红褐色的氢氧化铁胶体 ⑦HCl
(1)上述物质中属于电解质的有________非电解质的有________ (填序号)
(2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是 。
(3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-==H2O,则该反应的化学方程式为____________________________________________。
参考答案:(1)④⑤⑦ ②③
(2)开始产生红褐色沉淀,后来沉淀溶解消失
(3)Ba(OH)2+2HCl====BaCl2+2H2O
本题解析:在水溶液中或熔融状态下能导电的化合物为电解质,在水溶液或熔融状态下均不能导电的化合物为非电解质,电解质在水溶液或熔融状态导电原因是因为自身电离产生能自由移动的阴阳离子,阴阳离子定向移动导电。故本题(1)中上述物质中属于电解质的有④H2SO4、⑤Ba(OH)2、⑦HCl;非电解质的有②蔗糖、③CO2;向⑥红褐色的氢氧化铁胶体中逐滴加入⑦HCl,首先电解质会导致胶体聚沉,故先产生红褐色沉淀,后HCl能够溶解Fe(OH)3,故后沉淀又溶解消失;H++OH-==H2O代表可溶性强酸与可溶性强碱反应生成可溶性盐与水的反应,故本题可表示:Ba(OH)2+2HCl====BaCl2+2H2O。
考点:物质类别及离子方程式书写。
本题难度:一般
2、选择题 下列反应对应的离子方程式中正确的是 ( )
A.铜与浓硝酸混合:Cu+4HNO3(浓)====Cu2++2 +2NO2↑+2H2O +2NO2↑+2H2O
B.用惰性电极电解MgCl2溶液:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH-
C.NaHSO4溶液与Ba(OH)2溶液混合呈中性: +Ba2++2OH-====BaSO4↓+ +2H2O
D.氢氧化铜溶于氢溴酸:Cu(OH)2+2H+====Cu2++2H2O
|
参考答案:D
本题解析:A错,浓硝酸应拆成H+、NO3—离子;B错,用惰性电极电解MgCl2溶液正确的方程式为:Mg2++2Cl-+2H2O Cl2↑+H2↑+Mg(OH)2↓;C错,正确离子方程式为:H++SO42—+Ba2+=BaSO4↓+H2O;D正确,氢氧化铜为难溶于水的碱; Cl2↑+H2↑+Mg(OH)2↓;C错,正确离子方程式为:H++SO42—+Ba2+=BaSO4↓+H2O;D正确,氢氧化铜为难溶于水的碱;
本题难度:一般
3、填空题 (10分)有以下物质:①Mg ②Al ③C ④稀硫酸 ⑤浓硫酸 ⑥NaOH溶液
(1)写出①与④反应的离子方程式 。
(2)既能跟④又能跟⑥反应的是 (填序号),写出它与⑥反应的化学方程式 。
(3)写出写出③与⑤反应的化学方程式 ,下列关于该反应中⑤体现的性质说法正确的是 。
a.既体现氧化性又体现酸性
b.只体现氧化性
c.只体现酸性
d.体现吸水性
参考答案:(1)Mg+2H+
本题解析:
本题难度:一般
4、填空题 (14分)尿素[CO(NH2)2]是一种非常重要的高氮化肥,以天然气(含H2S)为原料合成尿素的主要步骤如下图所示(图中某些转化步骤未列出)。

请回答下列问题:
(1)反应①的离子方程式是____________。
(2)天然气脱硫后产生的Fe2S3和H2O与02反应的化学方程式是_______。
(3)反应②N2+3H2 2NH3△H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。 2NH3△H<0,温度升高,该反应的平衡常数_______ (填 “增大”、“减小” 或“不变”)。如该反应在恒容恒温条件下进行,下列说法能判断达到平衡的是 。
A.单位时间内生成nmol N2同时消耗3nmol H2
B.混合气体的密度不变
C.混合气体的平均摩尔质量不变
D.N2、H2、NH3浓度之比为1:3:2
|
(4)H2NCOONH4(氨基甲酸铵)是合成尿素的中间体,H2NCOONH4在水溶液中要发生水解反应,其水解反应的离子方程式为:
。
(5)如果整个生产过程
参考答案:
本题解析:
本题难度:困难
5、计算题 (一)(10分)标准状况下,向100 mL NaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液显碱性(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
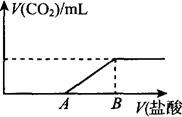
已知图中B点位置固定,V(B)="300" m l。,而点A、C可在各自的轴上移动。
(1)原溶液的物质的量浓度为 mol/L。B点时,最终所得溶液中的溶质的物质的量浓度是 mol/L。(两种溶液混合时体积可以直接相加)。
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
V(A)的取值
| V(A)=0
| 0<V(A)<150
| V(A)=150
| 150<V(A)<300
|
溶质的成分
| ①
| ②
| ③
| ④
|
(3)取V(A)="100" mL时对应的溶液M 30 mL与等体积的l mol/L的盐酸按各种可能的方式混合,产生的气体体积V mL,则V的取值范围是
。
(二)(5分)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。求
①混合物中Cu的质量为_____________
②产生的NO在标准状况下的体积为_____________
参考答案:(一)(10分)(1)3 (2分) 0.75(1分)(2)①NaHCO3(1分)②Na2CO3和NaHCO3(1分) ③Na2CO3(1分)④Na2CO3和NaOH(1分);(3)0≤V≤448(3分)(二) (5分) ①12.8 g (3分) ②4.48 L (2分)
本题解析:(一)(1)当盐酸体积是300mL时溶液中的溶质是NaCl,n(Na+)=n(Cl-)=n(HCl)="0.3L×1" mol/L=0.3mol,NaOH溶液的浓度为:0.3mol÷0.1L="3" mol·L-1,最终溶液中Na Cl的物质的量浓度为:0.3mol÷0.4L="0.75" mol/L。(2)NaOH溶液中缓慢通入一定量的CO2气体发生的反应有:2NaOH+CO2 Na2CO3+H2O,Na2CO3+H2O +CO2
Na2CO3+H2O,Na2CO3+H2O +CO2 2NaHCO3,溶液M中的溶质的成分可能存在的几种可能:①NaHCO3、②NaHCO3和Na2CO3、③Na2CO3、④Na2CO3和NaOH,加入盐酸可能发生的反应有:HCl +NaOH
2NaHCO3,溶液M中的溶质的成分可能存在的几种可能:①NaHCO3、②NaHCO3和Na2CO3、③Na2CO3、④Na2CO3和NaOH,加入盐酸可能发生的反应有:HCl +NaOH NaCl+H2O、HCl +Na2CO3
NaCl+H2O、HCl +Na2CO3 NaCl+NaHCO3、HCl +NaHCO3
NaCl+NaHCO3、HCl +NaHCO3 NaCl+CO2↑+ H2O,NaHCO3和盐酸反应物质的量比为1
NaCl+CO2↑+ H2O,NaHCO3和盐酸反应物质的量比为1
本题难度:一般

 Na2CO3+H2O,Na2CO3+H2O +CO2
Na2CO3+H2O,Na2CO3+H2O +CO2 2NaHCO3,溶液M中的溶质的成分可能存在的几种可能:①NaHCO3、②NaHCO3和Na2CO3、③Na2CO3、④Na2CO3和NaOH,加入盐酸可能发生的反应有:HCl +NaOH
2NaHCO3,溶液M中的溶质的成分可能存在的几种可能:①NaHCO3、②NaHCO3和Na2CO3、③Na2CO3、④Na2CO3和NaOH,加入盐酸可能发生的反应有:HCl +NaOH NaCl+H2O、HCl +Na2CO3
NaCl+H2O、HCl +Na2CO3 NaCl+NaHCO3、HCl +NaHCO3
NaCl+NaHCO3、HCl +NaHCO3 NaCl+CO2↑+ H2O,NaHCO3和盐酸反应物质的量比为1
NaCl+CO2↑+ H2O,NaHCO3和盐酸反应物质的量比为1