1、选择题 有一未完成的离子方程式为+XO3-+6H+=3X2+3H2O,据此判断,X元素的最高化合价为
A.+7
B.+4
C.+5
D.+1
参考答案:A
本题解析:分析:根据离子方程式遵循电荷守恒,和氧化还原反应遵循得失电子守恒以及质量守恒定律分析.
解答:根据离子方程式左右电荷相等,则未知物应含有5个负电荷,
根据方程式遵循质量守恒定律可知,如生成3molX2,则XO3-为1mol,未知物为5mol,
所以1mol未知物含有1mol负电荷,即X的最低化合价为-1价,
最X原子核外有7个电子,最高化合价为+7价.
故选A.
点评:本题考查离子方程式的书写和推断,题目难度中等,注意从守恒的角度解答,解答本题的关键是正确推断未知物的物质的量和化合价.
本题难度:一般
2、选择题 下列离子方程式正确的是
A.硫化钠的水解反应:S2-+H3O+═HS-+H2O
B.氧化铝溶解在NaOH溶液中:3H2O+Al2O3+2OH-═2Al(OH)4-
C.硫酸铝溶液与氢氧化钡溶液反应,使SO恰好沉淀完全Al3++SO42-+Ba2++3OH-═BaSO4↓+Al(OH)3↓
D.在漂白粉配制成的溶液中通入SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
参考答案:B
本题解析:分析:A.硫离子水解生成硫氢根离子和氢氧根离子;
B.反应生成偏铝酸钠;
C.硫酸根离子完全沉淀,硫酸铝与氢氧化钡以1:3反应,反应生成硫酸钡和氢氧化铝;
D.发生氧化还原反应生成硫酸钙和盐酸.
解答:A.硫化钠的水解反应的离子反应为S2-+H2O?HS-+OH-,故A错误;
B.氧化铝溶解在NaOH溶液中的离子反应为3H2O+Al2O3+2OH-═2Al(OH)4-,故B正确;
C.硫酸铝溶液与氢氧化钡溶液反应,使SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓,故C错误;
D.在漂白粉配制成的溶液中通入SO2的离子反应为Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl-,故D错误;
故选B.
点评:本题考查离子反应方程式的书写,明确发生的反应是解答的关键,注意选项D中的氧化还原的离子反应为解答的难点,题目难度中等.
本题难度:简单
3、选择题 下列离子方程式正确的是
A.乙酸与碳酸钠溶液反应:2H++CO32-═CO2↑+H2O
B.甲酸溶液与滴入少量的新制氢氧化铜后共热:HCOOH+2Cu(OH)2Cu2O+CO2↑+3H2O
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O2C6H5OH+CO32-
D.甲醛溶液与足量的银氨溶液共热:HCHO+4[Ag(NH3)2]++4OHCO32-+2NH4++4Ag↓+6NH3+2H2O
参考答案:D
本题解析:分析:A.乙酸为弱酸;
B.反应Cu(HCOO)2、水;
C.反应生成碳酸氢钠和苯酚;
D.甲醛溶液与足量的银氨溶液共热,二者的反应的物质的量之比为1:4.
解答:A.乙酸与碳酸钠溶液反应的离子反应为2HAc+CO32-═CO2↑+H2O+2Ac-,故A错误;
B.甲酸溶液与滴人少量的新制氢氧化铜后共热的离子反应为2HCOOH+Cu(OH)2 Cu2++2HCOO-+2H2O,故B错误;
Cu2++2HCOO-+2H2O,故B错误;
C.苯酚钠溶液中通人少量二氧化碳的离子反应为C6H5O-+CO2+H2O C6H5OH+HCO3-,故C错误;
C6H5OH+HCO3-,故C错误;
D.甲醛溶液与足量的银氨溶液共热的离子反应为HCHO+4[Ag(NH3)2]++4OH CO32-+2NH4++4Ag↓+6NH3+2H2O,故D正确;
CO32-+2NH4++4Ag↓+6NH3+2H2O,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,并熟悉离子反应方程式的书写方法来解答,题目难度不大.
本题难度:一般
4、选择题 下列分子中所有原子全部满足最外层为8个电子结构的是
A.PCl5
B.NH3
C.PCl3
D.BF3
参考答案:C
本题解析:试题分析:C项:PCl3的电子式为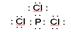 且全部满足最外层为8电子,正确;而A项错误;B、D项不满足8电子
且全部满足最外层为8电子,正确;而A项错误;B、D项不满足8电子
考点:电子式的相关知识。
本题难度:简单
5、选择题 在元素周期表中,第3、4、5、6周期所含元素的数目分别是
A.8、18、32、32
B.8、18、18、32
C.8、18、18、18
D.8、8、18、18
参考答案:B
本题解析:考查元素周期表的结构,元素周期表共计7行,分为7铬周期,分别含有的元素种类是2、8、8、18、18、32、32(排满后),答案选B。
本题难度:一般