1、选择题 分别处在第二、三周期的主族元素X和Y,它们离子的电子层相差两层.已知X处于第m族,Y处于第n族,X只有正化合价,则X、Y原子核外的电子总数分别为
A.(m+2)、(10+n)
B.m、n
C.3、7
D.(m-2)、(10-n)
参考答案:A
本题解析:试题分析:X处于第二周期、第m族,因此X的原子核外电子数为(m+2);而Y处于第三周期、第n族,因此Y原子核外电子数为(n+10)。故答案选A。
考点:原子结构
点评:考查元素周期表中的原子结构,属于基础内容。复习备考中,应注意掌握周期表的结构以及原子的结构,从而推断元素在周期表中的位置,可以达到事半功倍的效果。
本题难度:一般
2、选择题 下列实验操作完全正确的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.能和硝酸酸化的氯化钡溶液产生白色沉淀的离子有银离子、硫酸根离子和亚硫酸根离子;
B.容量瓶不能溶解药品;
C.测定酸碱滴定曲线时,眼睛要注视锥形瓶内溶液颜色变化;
D.分液时,上层液体从上口倒出,下层液体从下口倒出.
解答:A.硝酸具有强氧化性,能把亚硫酸根离子氧化生成硫酸根离子,且能和硝酸酸化的氯化钡溶液产生白色沉淀的离子有银离子、硫酸根离子和亚硫酸根离子,故A错误;
B.容量瓶只能用来配制一定物质的量浓度的溶液,不能溶解固体药品或稀释浓溶液,故B错误;
C.测定酸碱滴定曲线时,左手控制活塞,右手转动锥形瓶,眼睛始终注视锥形瓶中溶液颜色的变化,从而确定滴定终点,故C正确;
D.分液时,为防止产生杂质,下层液体从分液漏斗下端管口放出,上层液体从上口倒出,故D错误;
故选C.
点评:本题考查实验基本操作、离子的检验等知识点,根据离子的检验方法、容量瓶的作用、酸碱中和滴定实验、分液方面来分析解答即可,易错选项是A,注意稀硝酸的强氧化性,为易错点.
本题难度:困难
3、选择题 下列晶体中,熔点最高的是:
A.KF
B.MgO
C.CaO
D.NaCl
参考答案:B
本题解析:所给的选项中的晶体全为离子晶体,对于离子晶体熔点的比较,需要比较离子键的强弱,一般离子所带的电荷数越多,离子半径越小离子键越强,离子晶体的熔点越高; MgO?和CaO所含的离子均为二价离子,电荷数较多,所以熔点较高,镁离子的半径小于钙离子,所以MgO 中离子健的强度大于CaO氧化钙中离子键的强度,那么MgO的熔点大于CaO答案选B。
本题难度:困难
4、选择题 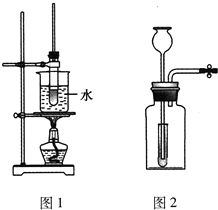 下列有关实验原理或操作正确的是
下列有关实验原理或操作正确的是
A.配制0.1?mol/L烧碱溶液时,容量瓶应先用0.1?mol/L烧碱溶液润洗
B.不用其他试剂即能鉴别出Al2(SO4)3、KOH、HCl、KCl四种溶液
C.实验室可用如图1所示的装置制备乙酸丁酯(已知乙酸丁酯的沸点为124~126℃,反应温度为115~125℃)
D.实验室用如图2所示的装置制备氢气时,该装置符合“随开随制、随关随停”的要求
参考答案:B
本题解析:分析:A.容量瓶不能用待测液润洗;
B.根据Al2(SO4)3与KOH相互滴加,顺序不同现象不同进行检验;
C.不能用水浴加热;
D.小试管只起到液封的作用,不能“随开随制、随关随停”.
解答:A.配制一定物质的量浓度的溶液时,容量瓶无需干燥、无需润洗,故A错误;
B.Al2(SO4)3与KOH相互滴加,顺序不同现象不同,生成的Al(OH)3可溶于盐酸,可鉴别,故B正确;
C.实验温度为115~125℃,不能用水浴加热,故C错误;
D.实验装置不符合“随开随制、随关随停”的要求,小试管只起到液封的作用,故D错误.
故选B.
点评:本题考查化学实验方案的评价,题目侧重于物质的检验、制备等实验基本操作的考查,题目难度不大,注意相关基础知识的学习.
本题难度:困难
5、选择题 下列说法正确的是
A.原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数
B.离子化合物中只有离子键,共价化合物中只有共价键
C.铵根离子呈正四面体结构
D.氨分子中氢原子、氮原子的化合价已饱和,不能再与其它原子或离子成键
参考答案:C
本题解析:A错误,应为其共价键数=8—原子的价电子数;B错误,离子化合物中一定有离子键,可以有共价键,而共价化合物中只有共价键;D错误,可以结合与H+以配位键结合。
本题难度:简单