|
高中化学知识点总结《水的电离平衡》高频试题巩固(2019年最新版)(四)
2019-05-30 03:39:14
【 大 中 小】
|
1、选择题 物质的量浓度相同的下列物质的水溶液,碱性最强的是
A.NaOH
B.NH3·H2O
C.Ba(OH)2
D.Na2CO3
|
参考答案:C
本题解析:NaOH 是强碱,NH3·H2O 是弱碱,Ba(OH)2是强碱,Na2CO3是盐类,所以从NaOH和Ba(OH)2中选,由于Ba(OH)2中有2个OH-,浓度相同的时候,Ba(OH)2中的OH-浓度更大,碱性更强,选C。
考点:物质酸碱性的比较。
本题难度:一般
2、填空题 NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+) (填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)

如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是 (填写字母),导致pH随温度变化的原因是 ;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)= 。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:

试分析图中a、b、c、d四个点,水的电离程度最大的是 ;在b点,溶液中各离子浓度由大到小的排列顺序是 。
参考答案:(1)Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.(2分) Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水.(2分)
(2)小于
(3)①ⅠNH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小 ②10-3mol·L-1
(4)a (Na+)>c(SO42-)>c(NH4+>c(OH-)=c(H+)
本题解析:(1)由于 NH4Al(SO4)2溶于水电离出的Al3+水解生成的Al(OH)3晶体具有吸附性,即Al3++3H2O Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水。 Al(OH)3+3H+,Al(OH)3吸附悬浮颗粒使其沉降从而净化水。
(2)由于NH4HSO4溶于水完全电离出氢离子,抑制NH4+水解,所以相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)小于0.1 mol·L-1NH4HSO4中c(NH4+)。
(3)①由于 NH4Al(SO4)2溶于水电离出的NH4+、Al3+水解溶液显酸性,且水解是吸热的,加入促进水解,溶液的酸性增强,pH减小,因此符合条件的曲线是I。
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中pH=3,根据电荷守恒可知,20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)+c(OH-) =c(NH4+)+c(H+)+3c(Al3+),则 2c(SO42-)-c(NH4+)-3c(Al3+)=c(H+)-c(OH-) =10-3-10-11mol·L-1。
(4)向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液反应的离子方程式因此为H++OH-=H2O、OH-+NH4+=NH3·H2O。d点恰好中和氢离子,溶液中的NH4+水解促进水的电离。D点之后NH4+浓度减小,所以溶液中水的电离程度最大是a点;在b点,pH=7,溶液显中性,溶液中的溶质是硫酸钠和硫酸铵和氨气,则溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+)。
考点:考查胶体性质、水的电离、盐类水解、溶液中离子浓度大小比较。
本题难度:困难
3、实验题 (8分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净后,用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且并不马上变色为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。试回答下列问题:
(1)锥形瓶中的溶液从 色变为 色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察
A、滴定管内液面的变化 B、锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是 由此造成的测定结果 (偏高、偏低或无影响)
(4)步骤②缺少的操作是
(5)下图,是某次滴定时的滴定管中的液面,其读数为 mL
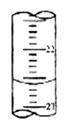
(6)根据下列数据:
滴定次数
| 待测液体积(mL)
| 标准盐酸体积(mL)
| 滴定前读数(mL)
| 滴定后读数(mL)
| 第一次
| 25.00
| 0.50
| 20.40
| 第二次
| 25.00
| 4.00
| 24.10
|
请计算待测烧碱溶液的浓度(保留四位小数) mol/L
参考答案:(每空1分,共8分)
(1)红色、无色 (2)B (3)待测液润洗锥形瓶 偏高
(4)酸式滴定管用蒸馏水洗净后,应用标准盐酸润洗2-3次
(5)22.60 (6)0.0800
本题解析:(1)锥形瓶中是氢氧化钠,加入酚酞,显红色,滴定后溶液变为无色。(2)滴定时眼睛要观察锥形瓶中溶液的颜色的变化。(3)步骤①中锥形瓶用待测液润洗,会造成氢氧化钠的浓度偏高。(4)步骤②缺少酸式滴定管用蒸馏水洗净后,应用标准盐酸润洗2-3次。(5)根据滴定管的数据特点,读数为:22.60毫升,(6)标准酸的体积平均值为20.00毫升,则0.1000×20.00=c×25.00,解c="0.0800" mol/L.
考点:酸碱中和滴定
本题难度:一般
4、选择题 水是生命之源,下列关于水的说法正确的是
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
B.某温度下,pH=6的蒸馏水显酸性
C.氯气有毒,因而自来水的杀菌消毒一定不能使用氯气
D.明矾可用于水的净化与杀菌消毒
|