1、选择题 已知水的电离方程式:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
[? ]
A.升高温度,Kw增大,pH不变
B.向水中加入少量硫酸,c(H+)增大,KW不变
C.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
参考答案:B
本题解析:
本题难度:一般
2、填空题 (14分)求25℃时以下溶液的pH
(1)pH=3的盐酸与pH=5的硫酸等体积混合后,pH= ____________
(2)pH=10和pH=12的两种NaOH溶液等体积混合后,pH= ____________
(3)pH=9的NaOH溶液稀释到原来的10倍后,pH= ____________,再稀释到原来的1000倍后,pH___________。
(4)pH=12的NaOH和pH= 4的HCl等体积混合后,pH= ____________
(5)pH=10的NaOH和pH=1的HCl等体积混合后,pH= ____________
(6)pH=12的NaOH和pH=2的HCl等体积混合后,pH= ____________
参考答案:26.(14分)(1) 3.3,(2) 11.7, (3) 8 ,≈7 ,(4) 11.7,(5) 1.3, (6) 7
本题解析:(1)设两种酸的体积都是1L,pH=3的盐酸与pH=5的硫酸等体积混合后,混合溶液中氢离子浓度=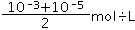 =5.05×10-4mol/L,则混合溶液的pH=-lg5.05×10-4=3.3,
=5.05×10-4mol/L,则混合溶液的pH=-lg5.05×10-4=3.3,
(2)(2)设两种碱的体积都是1L,pH=10和pH=12的两种NaOH溶液等体积混合后,混合溶液中氢氧根离子浓度=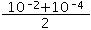 mol/L=5.05×10-3mol/L,则混合溶液中氢离子浓度=
mol/L=5.05×10-3mol/L,则混合溶液中氢离子浓度=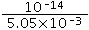 mol/L=2×10-12mol/L,pH=11.7,
mol/L=2×10-12mol/L,pH=11.7,
(3)强碱溶液稀释10倍是溶液的pH减小1,所以pH=9的NaOH溶液稀释到原来的10倍后,pH=8,再稀释到原来的1000倍后,溶液接近中性,则pH≈7,
(4)设酸和碱的体积都是1L,pH=12的NaOH中c(OH-)=0.01mol/L,pH=4的HCl中c(H+)=0.0001mol/L,等体积混合后,混合溶液中c(OH-)=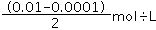 =5.05×10-3mol/L,则混合溶液中氢离子浓度=
=5.05×10-3mol/L,则混合溶液中氢离子浓度=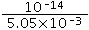 mol/L=2×10-12mol/L,pH=11.7,
mol/L=2×10-12mol/L,pH=11.7,
(5)设酸和碱的体积都是1L,pH=12的NaOH中c(OH-)=0.01mol/L,pH=1的HCl中c(H+)=0.1mol/L,等体积混合后,混合溶液中氢离子浓度= =0.045mol/L,pH=1.3,
=0.045mol/L,pH=1.3,
(6)设酸和碱的体积都是1L,pH=12的NaOH中c(OH-)=0.01mol/L,pH=2的HCl中c(H+)=0.01mol/L,等体积混合后,酸和碱的物质的量相等,则溶液呈中性,pH=7,
考点:考查混合溶液PH的计算。
本题难度:一般
3、选择题 向蒸馏水中滴入少量稀盐酸后,下列说法错误的是
[? ]
A.c(H+)·c(OH-)乘积不变
B.溶液pH减小
C.c(OH-)降低了
D.水电离出的c(H+)增加了
参考答案:D
本题解析:
本题难度:一般
4、选择题 常温下,下列对有关溶液的判断不正确的是( )
A.Na2CO3溶液中,c(OH-) = c(H+)+c(HCO3