1、选择题 右图为元素周期表短周期的一部分,E原子的电子层数为n,最外层电子数为2n+1下列述不正确的是
A.C和E氢化物的热稳定性和还原性均依次减弱
B.A与B形成的阴离子可能有AB32- A2B42-
C.AD2分子中每个原子的最外层均为8电子结构
D.A、D、E的最高价氧化物对应的水化物的酸性依次增强
参考答案:A
本题解析:依题知E在第三周期,n=3,则最外层电子数是7,E是Cl。其它元素分别是,A是C,B是O,C是F,D是S;C和O可以形成CO32-和C2O42-(草酸根离子),所以B正确。
本题难度:一般
2、填空题 部分中学化学常见元素原子结构及性质如表所示:
序号
| 元素
| 结构及性质
|
①
| A
| A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5
|
②
| B
| B原子最外层电子数是内层电子总数的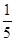
|
③
| C
| C是常见化肥的主要元素,单质常温下呈气态
|
④
| D
| D单质被誉为“信息革命的催化剂”,是常用的半导体材料
|
⑤
| E
| 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物
|
⑥
| F
| F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族
|
?
(1)A原子在周期表中的位置为________。
(2)B与C形成的化合物的化学式为________,它属于________化合物(填“离子”或“共价”)。
(3)F与E可以形成10电子和18电子的两种化合物X和Y,区别X与Y的水溶液的实验方法是________________________________________________________________。
(4)C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱_____________________________________________________________。
(5)列举一个实验事实证明A、B两种元素单质还原性的强弱_________________________________________________________________。
参考答案:(1)第四周期、第Ⅷ族 (2)Mg3N2 离子
(3)分别取X、Y少许置于试管中,再各加入少量的MnO2粉末,迅速产生无色气体的是H2O2;无明显现象的是H2O(利用加其他催化剂或利用H2O2的漂白性和氧化性等,其他合理方法同样给分)
(4)4NH3+3O2 2N2+6H2O或N2H4+O2
2N2+6H2O或N2H4+O2 N2+2H2O
N2+2H2O
(5)取相同形状、相同大小的两种单质分别与相同浓度的稀盐酸反应,Mg的反应速率比Fe的反应速率快(其他合理答案同样给分)
本题解析:根据表格中提供的信息,可以推断A为Fe,B为Mg,C为N,D为Si,E为O,F为H。O2的氧化性强于N2,可以通过单质的置换反应验证。
本题难度:简单
3、选择题 下列选项中,表示ⅤA族某元素原子结构示意图的是?
参考答案:A
本题解析:第ⅤA族元素的原子序数自上而下分别是7、15、33、51、83等,A是氮元素,B是O元素,C是氯元素,D是镁元素,因此答案选A。
点评:该题是基础性试题的考查,主要是考查学生 对元素周期表结构的熟悉掌握程度,记住即可,难度不大,学生不难得分。
本题难度:一般
4、选择题 在短周期元素中,若某元素原子的最外层原子数与其电子层数相等,则符合条件的元素种数为(? )
A.1种
B.2种
C.3种
D.4种
参考答案:C
本题解析:解题时要注意元素为短周期元素,因此该元素只可能为H、Be、Al。
本题难度:简单
5、选择题 高岭土(Al2O3·2SiO2·2H2O)是制造瓷器的主要原料,其组成可以表示为Al2Si2Ox(OH)y。其中x、y的数值 分别是
[?]
A.7、2
B.5、4
C.6、3
D.3、6
参考答案:B
本题解析:
本题难度:简单