|
高考化学知识点总结《盐类水解的原理》高频考点巩固(2019年模拟版)(四)
2019-05-30 03:40:15
【 大 中 小】
|
1、选择题 下列实验操作或对实验事实的叙述中不正确的是( )
A.用50mL酸式滴定管准确量取25.00mL酸性KMnO4溶液,放入锥形瓶待用
B.室温下,测定浓度为0.1?mol?L-1?NaClO溶液和0.1?mol?L-1CH3COONa溶液的pH,比较HClO和CH3COOH的酸性强弱
C.实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉
D.配制1?mol?L-1的NaOH溶液时,下列操作会造成所配浓度偏低:定容时仰视刻度线;容量瓶中原有少许蒸馏水
参考答案:D
本题解析:
本题难度:简单
2、选择题 已知酸H2B在水溶液中存在下列关系:①H2B = H++HB—,②HB—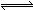 H++B2—,则下列说法中一定正确的是 H++B2—,则下列说法中一定正确的是
A.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
B.Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性
C.NaHB水溶液中一定有:c(Na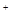 )+c(H )+c(H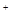 )=c(HB )=c(HB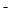 )+c(OH )+c(OH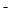 )+c(B )+c(B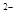 ) )
D.在Na2B溶液中一定有:c(OH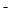 )=c(H )=c(H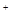 )+c(HB )+c(HB ) )
|
参考答案:AD
本题解析:
正确答案:AD
A.正确,NaHB不水解,溶液一定呈酸性,Na2B水解,溶液一定呈碱性
B.不正确;
C.不正确,NaHB水溶液中一定有:电荷守恒应为c(Na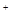 )+c(H )+c(H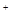 )=c(HB )=c(HB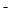 )+c(OH )+c(OH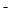 )+2c(B )+2c(B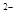 ) )
D.正确,在Na2B溶液中存在质子守恒,一定有:c(OH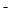 )=c(H )=c(H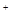 )+c(HB )+c(HB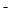 ) )
本题难度:一般
3、填空题 雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):

(1)装置Ⅰ中的主要离子方程式为 。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
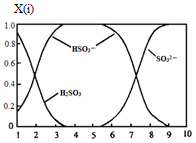
①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: &# 160; 。
(3)写出装置Ⅱ中,酸性条件下的离子方程式 。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
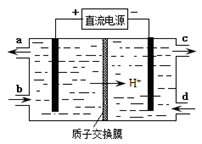
①生成Ce4+从电解槽的 (填字母序号)口流出。
②写出与阴极的反应式 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示,计算结果保留整数)
参考答案:(每空2分)
(1)SO2 + OH-="==" HSO3-
(2)①c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
②HSO3- 在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。 SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。
(3)NO+2H2O+3Ce4+===3Ce3++NO3-+4H+、NO+H2O+Ce4+===Ce3++NO2-+2H+
(4)①a ②2HSO3-+4H++ 4e-="==" S2O32-+3H2O
(5)243a(242a、244a、5600a /23都给分)
本题解析:(1)装置Ⅰ中的将SO2变成了HSO3-,离子方程式是SO2 + OH-="==" HSO3-。
(2)①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,图像中的c(SO32-)>c(HSO3-),而c(OH-)=10-6mol/L,远小于c(OH-),故溶液中离子浓度为:c(Na+>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)。②HSO3- 在溶液中存在电离平衡:HSO3- SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。 SO32-+H+,加入CaCl2溶液后,Ca2++SO32-="==" CaSO3↓使电离平衡右移,c(H+)增大。
(3)在酸性条件下装置Ⅱ中,Ce4+将NO氧化为NO3-或NO2-,本身还原为Ce3+,有两个反应,即NO+2H2O+3Ce4+===3Ce3++NO3-+4H+、NO+H2O+Ce4+===Ce3++NO2-+2H+。
(4)装置Ⅲ使Ce3+→Ce4+,反应过程失去电子,在阳极发生,接电源正极,故生成Ce4+从电解槽的a口出来;阴极HSO3-得到电子生成S2O32,即2HSO3-+4H++ 4e-="==" S2O32-+3H2O。
(5)装置Ⅳ中的与O2和NO2-参加的反应:2NH3+2H++O2+2NO2-===2NH4NO3,n(O2)=n(NO2-)= ×1000L×a g·L-1/46g·mol-1,V(O2)=22.4L·mol-1 n(O2)= 243a。
考点:离子方程、电极反应式的书写及简单化学计算。
本题难度:困难
4、填空题 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。

(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(加热仪器和夹持装置已略去)。

① 仪器A的名称是 。
② 装置B中发生反应的离子方程式是 。
③如果浓盐酸不能顺利滴下,可能的原因是 。
④装置Ⅳ中盛装的试剂是 ,其作用是 。
(2)在CuCl2溶液转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为黄绿色。小组同学欲探究其原因。
已知:在氯化铜溶液中有如下转化关系:
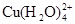 (aq) +4Cl-(aq) (aq) +4Cl-(aq)  (aq) +4H2O(l) (aq) +4H2O(l)
蓝色 黄色
①上述反应的化学平衡常数表达式是K= 。
②现欲使溶液由黄色变成蓝色,请写出两种可采用的方法
a. b 。
(3)由CuCl2溶液得到CuCl2·2H2O的过程中要加入盐酸的目的是 。
参考答案:(1)①分液漏斗
②MnO2+4H++3Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O
③分液漏斗的上口瓶塞没有打开
④NaOH溶液 吸收未反应的氯气,防止污染
(2)①K=c( )/c( )/c(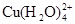 )c4(Cl-) )c4(Cl-)
② a 加水稀释 b AgNO3溶液
(3)抑制铜离子的水解,提高产品的产率。
本题解析:(1)氯气有毒,必须进行尾气处理
(2)变为蓝色则平衡向逆方向移动,可以加水,增加生成的浓度,也可以加入AgNO3溶液减少Cl-浓度。
(3)Cu2+易发生水解,加热促进水解,同时HCl易挥发,也促进水解,所以直接加热得不到氯化铜晶体。
本题难度:困难
5、填空题 工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。
(1)若采用无隔膜法电解冷的食盐水时,Cl2会与NaOH充分接触,导致产物仅是NaClO和H2。无隔膜法电解冷的食盐水相应的离子方程式为 。
(2)氯碱工业耗能高,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
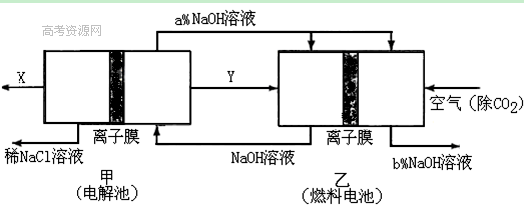
①经精制的饱和NaCl溶液应从图中电解池的 (填写“左” 或“右”)池注入。
②图中X是____ __(填化学式);乙中右室的电极反应式为: _ ,图示中氢氧化钠溶液质量分数a%与b%的关系是 (填字母)。
A. a%=b% B. a%
参考答案:
本题解析:
本题难度:困难
|