| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《盐类水解的原理》高频考点巩固(2019年模拟版)(十)
参考答案:A 本题解析:200mL0.1 mol·L-1CH3COOH与200mL0.1 mol·L-1NaOH溶液混合,恰好生成醋酸钠溶液,则溶液呈碱性,所以c(Na+)>c(CH3COO-)>c(OH-) > c(H+),B、D错误;根据电荷守恒,则c(Na+)+ c(H+) = c(CH3COO-)+ c(OH-),C错误;根据物料守恒,则c(Na+) = c(CH3COO-)+ c(CH3COOH),A正确,答案选A。 本题难度:一般 3、选择题 0.1?mol·L-1的下列物质的水溶液中,氢离子浓度最大的是 参考答案:C 本题解析:盐酸是强酸,盐所以盐酸溶液中氢离子的浓度最大,酸性最强。答案选C。 本题难度:一般 4、填空题 (12分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-,HA- |
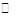 Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。
Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。参考答案:(1)酸 HA-只电离不水解 (2)B
(3)增大 H+与A2-结合为HA-,使平衡右移,c(Ca2+)增大 (4)2.5×10-10 mol/L
本题解析:(1)由于H2A===H++HA-,所以HA-只电离不水解,故溶液呈酸性;(2) )某温度下溶液呈中性,PH不一定为7;溶液呈中性c(OH-)=" c" (H+),所以水的离子积Kw=c2(OH-);10 mL 0.1 mol·L-1 NaHA溶液中加入10 mL 0.1 mol·L-1 KOH溶液,恰好完全反应生成Na2A,由于A2—水解,溶液呈碱性,要使溶液呈中性,加入氢氧化钾的体积小于10mL;所以c(K+) <c(Na+),故B正确;(3) A2-+H+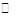 HA-,加入盐酸,A2-减少,CaA(s)
HA-,加入盐酸,A2-减少,CaA(s)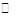 Ca2+(aq)+A2-(aq),平衡正向移动,故c(Ca2+)增大;(4) c(Ca2+) c(A2-)= 2.0×10-11,c(Ca2+)=0.08 mol·L-1,所以c(A2-)= 2.5×10-10 mol/L。
Ca2+(aq)+A2-(aq),平衡正向移动,故c(Ca2+)增大;(4) c(Ca2+) c(A2-)= 2.0×10-11,c(Ca2+)=0.08 mol·L-1,所以c(A2-)= 2.5×10-10 mol/L。
考点:本题考查化学试剂的标志。
本题难度:一般
5、填空题 【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。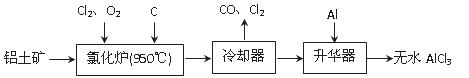
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
参考答案:(1)Al2O3+3Cl2+3C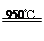 2AlCl3+3CO(2分)
2AlCl3+3CO(2分)
(2)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(3)除去FeCl3(2分)
(4)①Fe3++3OH-=Fe(OH)3↓(2分) Al3++4OH-=AlO2-+2H2O(2分)②96%(2分)
(5)在HCl气流中加热脱结晶水(2分)
(6)Fe3C+3O2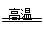 Fe3O4+CO2(1分)
Fe3O4+CO2(1分)
本题解析:⑴在氯化炉中发生的反应物有Al2O3、Cl2、C,生成物有AlCl3、CO(在冷却器中逸出),根据氧化还原反应的配平方法将其配平,并写出反应条件(950℃);
⑵书写Na2SO3溶液与Cl2反应的离子方程式时,先根据得失电子守恒有SO32-+Cl2
本题难度:困难
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《苯的结构》.. | |