1、选择题 把3mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+B(g)  xC(g)+2D(g)。5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论错误的是
xC(g)+2D(g)。5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论错误的是
A.A的平均反应速率为0.15mol/(L·min)
B.平衡时,C的浓度为0.25mol/L
C.平衡时,B的转化率为20%
D.平衡时,容器内压强为原来的0.8倍
参考答案:D
本题解析:根据反应速率之比是相应的化学计量数之比可知,A的反应速率是0.10mol/(L·min)×1.5=0.15mol/(L·min),A正确;B的反应速率是0.05mol/(L·min),即消耗B是0.05mol/(L·min)×2L×5min=0.5mol,所以B的转化率是0.5÷2.5=0.2,选项C正确;由于压强减小,所以x=1,则平衡时C的浓度是0.5mol÷2L=0.25mol/L,选项B正确;平衡时,容器内压强为原来的 ,所以选项D不正确,答案选D。
,所以选项D不正确,答案选D。
本题难度:一般
2、选择题 一定温度下,反应A2(g)+B2(g) 2AB(g)达到化学平衡状态的标志是(?)
2AB(g)达到化学平衡状态的标志是(?)
A.A2、B2和AB的浓度不再改变
B.A2、B2和AB在密闭容器中共存
C.容器内的压强不随时间而改变
D.单位时间里每生成1molA2,同时生成1molB2
参考答案:A
本题解析:A2(g)+B2(g) 2AB(g)是一个两边气体系数相等的可逆反应,只要反应开始,反应混合物就是共存状态,气体的总量不会改变,压强也不会改变。当达到平衡是,正逆反应速率相等,各物质的浓度将不再变化,故答案为A;而D选项单位时间里每生成1molA2,同时生成1molB2都是描述的逆反应速率,并不能说明正逆反应速率相等。
2AB(g)是一个两边气体系数相等的可逆反应,只要反应开始,反应混合物就是共存状态,气体的总量不会改变,压强也不会改变。当达到平衡是,正逆反应速率相等,各物质的浓度将不再变化,故答案为A;而D选项单位时间里每生成1molA2,同时生成1molB2都是描述的逆反应速率,并不能说明正逆反应速率相等。
本题难度:简单
3、选择题 已知甲为恒压容器、乙为恒容容器。。发生反应:2NO2(g)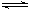 N2O4 (g)?△H<0。一段时间后相继达到平衡状态。下列说法中正确的是(? )
N2O4 (g)?△H<0。一段时间后相继达到平衡状态。下列说法中正确的是(? )
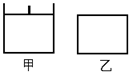
A.平衡时NO2体积分数:甲<乙
B.达到平衡所需时间,甲与乙相等
C.该反应的平衡常数表达式K=c(N2O4)/c(NO2)
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
参考答案:A
本题解析:相同条件下充入等物质的量的NO2气体,且起始时体积相同。反应发生时,气体体积减小,甲容器活塞下移,相当于增大压强,平衡向右移动。所以:A、正确;B、甲容器相当于加压,化学反应速率加快,先到达平衡;C、反应的平衡常数表达式K=c(N2O4) /c(NO2)2,所以C错;D、甲的压强恒定,不能作为平衡的标志。
本题难度:一般
4、填空题 (1) 反应: 2A(g)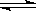 B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
B(g ) xC(g) 在一定的条件下达到平衡状态, 密闭容器中的压强增大P%, 测得A的转化率为 P%, 则x的值为 __________.
(2) 在容积相同的两密闭容器A和B中, 保持温度为 423K, 同时向A和B中分别加入 a mol 和 b mol 的HI(a > b), 待反应: 2HI(g)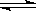 H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
H2(g)+ I2(g)到平衡后, 用 “ > < 或 ="”" 回答下列问题:
从反应开始到达到平衡所需要时间: tA _______ tB(填>,<, =",?" 下同)
平衡时的碘的浓度: c(I2 )A?c(I2 )B
HI的平衡分解百分率为:  .
.
参考答案:(1)? 3? (2)<? ,>? ,=
本题解析:略
本题难度:简单
5、填空题 有甲、乙两个容积均为1 L的密闭容器,在控制两容器的温度相同且恒定的情况下进行反应:2A(g)+B(g)  xC(g),①向甲中通入4 mol A、2 mol
xC(g),①向甲中通入4 mol A、2 mol  B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
B,达平衡时测得其中C的体积分数为40%;②向乙中通入1 mol A、0.5 mol B和3 mol C,平衡时测得C的体积分数为W%。试回答:
(1)若乙W%=40%,且建立平衡的过程中乙压强有变化,则x=?。
(2)若乙W%=40%,且平衡时甲、乙压强不同,则乙平衡时c(A) =?。
(3)若x=4,则W%?40% (填“大于”、“小于”或“等于”)。
参考答案:
本题解析:略
本题难度:一般