1、实验题 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
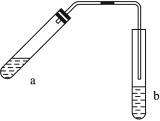
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序操作是__________
_______________________________________________________________________________。
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是_______________
_______________________________________________________________________________。
(3)实验中加热试管的目的是:
①__________________________________________________________________________
②__________________________________________________________________________
(4)试管b中加有饱和Na2CO3溶液,其作用是_____________________________________,
_______________________________________________________________________________。
(5)反应结束后,振荡试管b,然后静置,观察到的现象是_______________________
_______________________________________________________________________________。
参考答案:(1)先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸
(2)在试管a中加入几粒沸石(或碎瓷片)
(3)①加快反应速率
②及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动
(4)吸收随乙酸乙酯蒸出的少量酸性物质和乙醇
(5)b中的液体分层,上层是透明的油状液体
本题解析:因浓硫酸与其他液体混合时会放出大量热,冰醋酸很容易挥发,所以先加入乙醇,再慢慢加入浓硫酸并注意摇动试管,最后加入冰醋酸。生成乙酸乙酯的反应为可逆反应,为加快反应速率并使平衡向正反应方向移动以提高乙酸乙酯的产率,可采用加热的方法。产物乙酸乙酯是一种无色透明的油状液体,不溶于水,密度比水小。?
本题难度:简单
2、填空题 (18分)A和B是具有相同碳原子数的一氯代物,A-I转换关系如图所示:
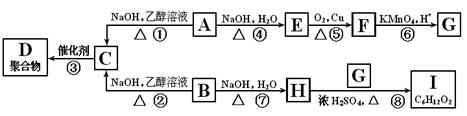
根据框图回答下列问题;
(1)B的结构简式是??;
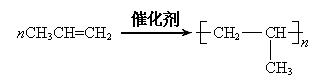
(2)反应③的化学方程式是??;
(3)上述转换中属于取代反应的是??;(填写反应序号)
(4)图中与E互为同分异构体的是?;(填化合物代号)。图中化合物带有的含氧官能团有?种。
(5)C在硫酸催化下与水反应的化学方程式是??;
(6)I的结构简式是?;名称是?。
参考答案:(18分,方程式每空3分,其他每空2分)
(1)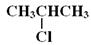
(2)
(3)④⑦⑧?(4)H;4
(5)2CH3CH=CH2+2H2O CH3CH(OH)CH3+CH3CH2CH2OH
CH3CH(OH)CH3+CH3CH2CH2OH
(6)CH3CH2COOCH(CH3)2;丙酸异丙酯
本题解析:略
本题难度:一般
3、实验题 某化学小组以苯甲酸为原料制取苯甲酸甲酯。有关物质的沸点和相对分子质量如表:
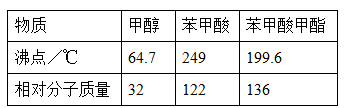
I.合成苯甲酸甲酯粗产品
在烧瓶中加入12.2g苯甲酸和20mL甲醇(密度约0.79g/mL) ,再小心加入3mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)该反应中浓硫酸的作用?,若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式?,甲醇过量的原因?。?
(2)如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是??。
(3)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的特点,最好采用?装置(填“甲”、“乙”、“丙”)。

Ⅱ.粗产品的精制
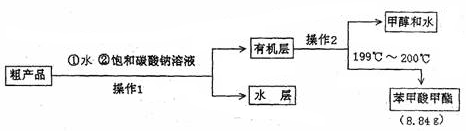
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为?,操作II为?。
(5)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是?。
(6)苯甲酸甲酯的产率为?。
参考答案:(1)催化剂和吸水剂,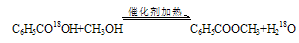 该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高产率
该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高产率
(2)冷却后补加
(3)乙
(4)分液;蒸馏
(5)将分液漏斗上口的玻璃塞打开(或使塞上的凹槽对准漏斗口上的小孔),再旋开分液漏斗活塞,用锥形瓶接收下层液体,待下层液体刚好流尽时关闭活塞,将有机层从分液漏斗上口倒入另一干净的容器(或烧杯)中
(6)65 %
本题解析:(1)甲醇和苯甲酸在浓硫酸作催化剂的条件下加热发生酯化反应得到苯甲酸甲酯和水。由于浓硫酸有吸水性,吸收反应产生的水,使酯化反应的平衡正向移动,可以提高反应物的转化率及产品的产率。所以在该反应中浓硫酸的作用是作催化剂和吸水剂。酯化反应的实质是酸脱羟基醇脱氢。所以该反应的化学方程式为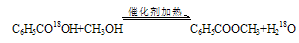 。甲醇要过量是因为该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高产率。(2)如果加热一段时间后发现忘记加碎瓷片,应该停止加热,冷却至室温,后再补加。
。甲醇要过量是因为该反应是可逆反应,甲醇比苯甲酸价廉,且甲醇沸点低,易损失,增加甲醇的量,可提高产率。(2)如果加热一段时间后发现忘记加碎瓷片,应该停止加热,冷却至室温,后再补加。
(3)甲虽然采用了冷却装置,但甲醇已经脱离了反应体系,对提高反应物的利用率不利,丙没有冷却降温装置,会导致一部分反应物及产物挥发逸出,无论是对环境还是对产品的制取都不利。而乙把甲、丙的优点集结在一起,既减少了反应物的挥发消耗,也提高了产品的产率。故选择乙装置。
(4)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,先加入水可以溶解硫酸,再加入饱和的Na2CO3溶液,既可以反应消耗苯甲酸,也可以降低苯甲酸甲酯的溶解度。由于它们是互补相容的液体,因此可常用分液的方法分离。在分液得到的有机物中因为甲醇与苯甲酸甲酯的沸点不同,将它们通过蒸馏分离开来。
(5)分液的具体操作是:将分液漏斗上口的玻璃塞打开(或使塞上的凹槽对准漏斗口上的小孔),再旋开分液漏斗活塞,用锥形瓶接收下层液体,待下层液体刚好流尽时关闭活塞,将有机层从分液漏斗上口倒入另一干净的容器(或烧杯)中。
(6)n(苯甲酸)="m/M=12.2g" ÷122g/mol=0.1mol;n(甲醇)=(20×0.79g) ÷32g/mol="15.8g÷32g/mol" =0.494mol。苯甲酸的物质的量不足,应该以苯甲酸为标准来进行计算。n(苯甲酸甲酯)=" m/M=8.84g÷" 136g/mol="0.065mol." 苯甲酸甲酯的产率为(0.065mol÷0.1mol)×100%="65" %
本题难度:一般
4、实验题 (9分)如图所示的仪器装置,在蒸馏烧瓶中装有冰醋酸、乙醇、浓硫酸和沸石,水浴加热,粗制乙酸乙酯。反应一段时间后,将粗产品倒入装有水的烧杯中,液体分为两层,现用两种方法检验乙酸乙酯和水层:第一种方法加入几滴KMnO4溶液,结果两层都没有颜色,无法区别;第二种方法是加入少量碘片,结果是上层液体呈紫红色。
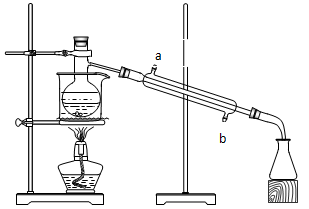
在这个实验中:(1)水浴的作用是?,浓硫酸的作用是?。
(2)水流经冷凝管时,应从?口进入。(填a或b)
(3)烧杯中乙酸乙酯在?层,根据是?,加入几滴KMnO4溶液后,水层不显紫色,是因为?。
(4)粗制乙酸乙酯经过提纯,可得到纯净的酯,提纯的操作方法是?。
参考答案:(1)使反应物受热均匀;催化剂、吸水剂? (2) b? (3)上;上层液体呈紫红色;? KMnO4氧化留在水层中的乙醇(以上每空1分,共7分)? (4)向粗制酯里加入饱和Na2CO3溶液,振荡后分液,分离出上层液即为纯净的酯。(2分)
本题解析:(1)反应需要加热,而采用水浴加热,可以使液体受热均匀。因为反应是可逆反应,有水生成,水浴浓硫酸的作用是催化剂和吸水机。
(2)冷凝时逆向冷却效果好,所以b口进水。
(3)乙酸乙酯的密度小于水的,所以在上层。因为碘易溶在有机物中,而上层呈紫红色,据此判断应该在上层。酸性高锰酸钾溶于具有强氧化性,能氧化水中的乙醇,所以颜色消失。
(4)要想得到乙酸乙酯,就需要除去挥发出的乙酸和乙醇,同时还不能减少乙酸乙酯,所以可利用饱和碳酸钠溶液,因为饱和碳酸钠可以吸收乙酸,溶解乙醇,同时降低乙酸乙酯的溶解度,最后通过分液即可。
本题难度:简单
5、实验题 (14分)(1)酯化反应:?跟?作用而生成?和?的反应。
(2)断键规律:酸去?基醇去??。
(3)右图为乙酸和乙醇在一定条件下制取乙酸乙酯的实验,
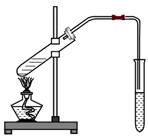
试叙述:该实验反应现象:?
反应化学方程式:?。
说明:①药品加入顺序:浓硫酸一定不能第一个加入。
②浓硫酸的作用:
③饱和碳酸钠作用: ? ?
④此反应是可逆反应
⑤长导管不能伸入到液面以下:
参考答案:(每空1分,共14分)(1)酸?、?醇?、?酯?、
水?。
(2)羟基?、?氢?。
(3)右侧试管液面上有无色油状有香味的液体出现?。
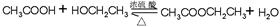 ?。
?。
说明: 催化剂 、 脱水剂 ?。
溶解挥发出的乙醇 、中和挥发出的乙酸 、 使生成物分层析出
本题解析:略
本题难度:简单