1、填空题 钢铁工业是国家工业的基础,请回答钢铁腐蚀、防护过程中的有关问题.
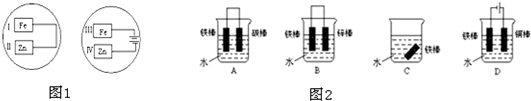
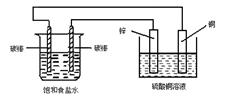
(1)若把锌片和铁片放在盛有食盐水和酚酞的表面皿中,如图1所示,能观察到酚酞变红的现象的区域是______(填I、II、III、IV),写出II处电极的电极反应式:______;写出IV处电极的电极反应式:______;写出该两种情况下发生的总反应的离子方程式:______;______.若把III的铁片改为碳棒,写出该处发生的电极反应式:______
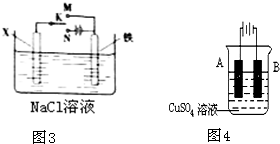
(2)如图2所示各个装置中铁棒被腐蚀由易到难的顺序是______(填字母)
(3)利用如图3装置,可模拟铁的电化学防护,下列有关说法正确的是______(填字母)
A.若X为碳棒,为减缓铁的腐蚀,开关K应置于M处
B.若X为锌板,K置于M或N处,均能减缓铁的腐蚀
C.若X为碳棒,K置于M或N处,一段时间后溶液pH均不变
D.若X为碳棒,K置于M或N处,Cl-均向X电极移动
(4)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀.装置如图4,请回答:
①B电极对应的金属是______(写元素名称),A电极的电极反应式是______
②若电镀前铁、铜两电极的质量相同,电镀完成后,若电镀时电路中通过的电子为0.2mol,将它们取出洗净、烘干、称量,则A、B两极质量相差______?g.
参考答案:(1)第一个装置是原电池,Zn为负极,溶液中的氧气在Ⅰ处得电子生成OH-,所以Ⅰ处变红;第二个装置是电解池,铁为阳极,溶液中的H+在Ⅳ处得电子,破坏了锌片附近水的电离平衡,使得OH-浓度增大,所以Ⅳ处变红,Ⅱ处是原电池的负极,电极反应为:Zn-2e-=Zn2+,Ⅳ处是电解池的阴极,发生电极反应为:2H++2e-=H2↑,该两种情况下发生的总反应的离子方程式:2Fe+O2+H2O=2Fe(OH)2、Fe+2H2O?通电?.?Fe(OH)2+H2↑,若把III的铁片改为碳棒,写出该处电极为惰性电极,发生的电极反应式:2Cl--2e-=Cl2↑,
故答案为:Ⅰ、Ⅳ;Zn-2e-=Zn2+;2H++2e-=H2↑;2Fe+O2+H2O=2Fe(OH)2;Fe+2H2O?通电?.?Fe(OH)2+H2↑;2Cl--2e-=Cl2↑;
(2)A、该装置中铁作负极,铁易失去电子而易被腐蚀;
B、该装置中铁作正极,铁电极上易得电子而被保护;
C、铁不发生电化学腐蚀;
D、铁作电解池的阴极而被保护;
同一种金属的腐蚀由快到慢的顺序是:电解池的阳极>原电池的负极>原电池正极>电解池阴极,所以铁棒被腐蚀由易到难的顺序ACBD,
故答案为:A>C>B>D;
(3)A、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,故A正确;
B、若X为锌棒,开关K置于M处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,若X为锌板,K置于N处,形成原电池,此时金属锌为负极,金属铁为正极,金属铁被保护,故B正确;
C、若X为碳棒,K置于N处,形成电解池,金属铁为阴极,该极上氢离子得电子放出氢气,氢离子减少,阳极上是氯离子失电子产生氯气,导致溶液的pH增大,故C错误;
D、若X为碳棒,K置于M处形成原电池,氯离子移向负极金属铁,K置于N处,Cl-均向阳极碳棒电极移动,故D错误;
故选AB;
(4)①在铁件的表面镀铜的电镀池中,作阳极A的是镀层金属铜,Cu-2e-=Cu2+,阴极B是金属铁,故答案为:铁;Cu-2e-=Cu2+;
②电镀时两极反应为:A电极:Cu-2e-=Cu2+,B电极上:Cu2++2e-=Cu,若电镀时电路中通过的电子为0.2mol,则A极上质量减少6.4g,B极上质量增加6.4g,所以A、B两极质量相差12.8g,故答案为:12.8.
本题解析:
本题难度:一般
2、填空题 (14分)电化学原理在现代生产生活中有着重要应用。
⑴燃料电池是目前发展势头强劲的优秀绿色环保电池。某新型氢氧燃料电池以H2为燃料,O2为氧化剂,H2SO4溶液为电解液),写出该电池的总反应方程式:?。
⑵铝电池性能优越,Al—AgO电池可用作水下动力电源,该电池反应的原理为:
Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。

①该电池反应的负极电极反应式?。
②图中隔膜为阴离子交换膜,溶液中OH-通过向?极移动(选填“正”或“负”)。
用Al—AgO电池作为电源,使用Pt电极电解500mL饱和NaCl溶液,电解一段时间后,恢复至室温,所得溶液pH=13(假设NaCl溶液足量且电解前后体积不变)。
③使用Pt电极电解NaCl溶液的离子方程式?;
电解过程中放出氢气的体积(标准状况下)为?L。
④若电池的效率为50%,该过程中消耗金属铝的质量为?g。
⑶用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离:Mg(OH)C1 = Mg(OH)+ + C1一。
电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为?。
参考答案:(14分)
⑴ 2H2+O2=2H2O?
⑵Al+4OH--3e-=AlO2-+2H2O?负? 2Cl-+2H2O 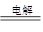 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
0.56?0.9
⑶2Mg(OH)++2e-=2MgO+H2↑ (每空2分)
本题解析:⑴燃料电池是目前发展势头强劲的优秀绿色环保电池。某新型氢氧燃料电池以H2为燃料,O2为氧化剂,H2SO4溶液为电解液),写出该电池的总反应方程式:2H2+O2=2H2O?。
铝电池性能优越,Al—AgO电池可用作水下动力电源,该电池反应的原理为:
Al+3AgO+2NaOH=2NaAlO2+3Ag+H2O。每消耗1mol铝转移电子是3mol;
①该电池反应的负极是铝,活泼金属能自发和氢氧化钠反应,其电极反应式Al+4OH--3e-=AlO2-+2H2O。
②图中隔膜为阴离子交换膜,溶液中OH-在负极要参与反应,所以向负极移动。
用Al—AgO电池作为电源,使用Pt电极电解500mL饱和NaCl溶液,电解一段时间后,恢复至室温,所得溶液pH=13(假设NaCl溶液足量且电解前后体积不变)。
③使用Pt电极电解NaCl溶液的离子方程式2Cl-+2H2O 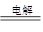 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
;500mL饱和NaCl溶液,电解后pH=13,所以产生的氢氧根物质的量浓度是0.1mol/L;其物质的量是0.05mol;由定量关系可知:生成的氢气是0.025mol。所以电解过程中放出氢气的体积V=22.4n=0.56 L(标准状况下)
④若电池的效率为50%,由电子转移守恒可得:电解时转移电子是0.05mol,所以原电池工作时消耗金属铝的质量为0.9g。
⑶用电解法制取镁时,若原料氯化镁含有水时,在电解温度下,原料会形成Mg(OH)Cl,并发生电离:Mg(OH)C1 = Mg(OH)+ + C1一。
电解时在阴极表面会产生氧化镁钝化膜,此时阴极的反应式为2Mg(OH)++2e-=2MgO+H2↑。
点评:解答此类问题需要注意的是,在原电池和电解池连用时要注意它们之间的唯一联系是电子转移守恒。
本题难度:一般
3、选择题 关于下图装置中的变化叙述错误的是
A.电子从锌片流向右侧碳棒,再从左侧碳棒流回铜片
B.锌片上发生氧化反应
C.左侧碳棒上发生:2H2O+O2+4e→4OH-
D.铜电极析出铜
参考答案:C
本题解析:A、锌片为电池的负极,正确;B、锌失电子发生氧化反应, 正确;C、左侧碳棒上发生:2Cl? - 2e?=Cl2↑,错误;D、铜电极发生铜离子得电子生成铜的反应。
本题难度:一般
4、简答题 (1)埋在地下的钢铁管道容易腐蚀而损坏,其原因在哪里?
______________________________________________________________
(2)应采取何种措施保护埋在地下的管道?
______________________________________________________________
参考答案:(1)地下钢铁管道容易腐蚀的原因是发生电化学腐蚀
(2)可在管道外壁涂沥青保护层,使钢铁管道跟周围电解质溶液隔离开来,破坏原电池形成的条件,从而使地下钢铁管道得到保护(或:把比Fe更活泼的Zn连接在钢铁管道,Zn作为原电池的负极被腐蚀,而钢铁管道则被保护)(答案合理即可)
本题解析:
本题难度:一般
5、选择题 市场上经常见到的标记为Li-ion的电池。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为: Li+2Li0.35NiO2? ?2Li0.85NiO?2,下列说法不正确的是( )
?2Li0.85NiO?2,下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e-=Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池既能用酸溶液又能用碱溶液作电解质溶液。
D.放电过程中Li+向正极移动
参考答案:C
本题解析:由方程式可知,锂单质变为锂的化合物化合价升高,所以放电时Li作电池负极,A正确;充电时,Li0.85NiO?2?生成 Li和Li0.35NiO2 成,Li的化合价一部分升高一部分降低,所以既发生成氧化反应又发生还原反应(即电解反应),B正确;电解质是能传导Li+的高分子材料,所以,不可以是酸、碱溶液,C错误;放电时Li+ 通过电解质溶液传导至正极并生成Li0.85NiO?2 化合物,所以D正确;故选C。
本题难度:一般