1、实验题 某同学想探究硫和碳原子的得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验,请回答:
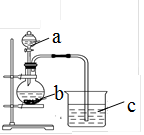
(1)仪器a的名称是?,应盛放下列药品中的?(填序号)。
A.稀硫酸? B. 亚硫酸? C. 氢硫酸? D. 盐酸
(2)仪器b应盛放下列药品中的?(填序号)。
A.碳酸钙? B. 硫酸钠? C. 氯化钠?D. 碳酸钠
(3)b中反应的离子方程式为?。
若看到仪器C中的现象是?,即可证明 ?比??酸性强(填化学式),得电子的能力?比?强。
参考答案:(1)分液漏斗;A(2)D(3)CO32-+2H+=H2O+CO2↑(2分)
澄清石灰水变浑浊?、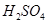 、?
、? 、?硫?、?碳?(各1分)
、?硫?、?碳?(各1分)
本题解析:(1)根据仪器的结构特点可知,a是分液漏斗。要比较它们最高价氧化物对应水化物的酸性强弱,则根据较强的酸制备较弱的原理可知,a中盛放的药品是稀硫酸,答案选A。(2)根据(1)中的分析可知,b中盛放的是碳酸盐。由于硫酸钙是微溶性物质,所以选择的是碳酸钠,答案选D。(3)b是制备CO2的,反应的离子方程式是CO32-+2H+=H2O+CO2↑。CO2能使澄清石灰水变混浊,则C中的实验现象是澄清石灰水变浑浊,据此可知硫酸比碳酸强,S的得到电子的能力强于碳原子的。
本题难度:一般
2、选择题 今年是门捷列夫诞辰180周年。下列事实不能用元素周期律解释的只有
A.碱性:KOH>NaOH
B.相对分子质量:Ar>K
C.酸性:HClO4>H2SO4
D.元素的金属性:Mg>Al
参考答案:B
本题解析:A、同主族自上而下金属性逐渐增强,最高价氧化物水化物的碱性逐渐增强,A不符合题意;B、相对分子质量与元素周期律没有关系,B符合题意;C、同周期自左向右非金属性逐渐增强,最高价氧化物水化物的酸性逐渐增强,C不符合题意;D、同周期自左向右金属性逐渐减弱,D不符合题意,答案选B。
本题难度:一般
3、选择题 下表二为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是(?)

A.通常情况下五种元素的单质中,Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.元素最高价氧化物对应的水化物的酸性Y比W强
参考答案:D
本题解析:根据元素在周期表中的位置可知,X是N,W是Si,Y是P,Z是Br,R是Ar。A不正确,硅是原子晶体,沸点最高。Br-的核外是4个电子层,B不正确。氨气中含有氢键,在同主族氢化物中沸点最高,C不正确。磷的非金属性强于硅的,所以D正确。答案选D。
本题难度:简单
4、选择题 已知元素的原子序数,可以推知原子的下列情况有
A.中子数
B.核电荷数
C.核外电子数
D.在周期表中的位置
参考答案:BCD
本题解析:原子序数=质子数=核电荷数=核外电子数,可以推知在周期表中的位置。
本题难度:简单
5、选择题 下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是(?)
A.K、Na、Li
B.Al、Mg、Na
C.N、O、C
D.Cl、S、P
参考答案:
 A
A
本题解析:考查元素周期律的应用。同周期自左向右原子半径逐渐减小,非金属性逐渐增强,金属性逐渐减弱;自上而下原子半径逐渐最大,非金属性逐渐减弱,金属性逐渐增强。金属性越强,非金属性越弱,第一电离能越小,所以选项A正确,其余选项都是错误的,答案选A。
本题难度:一般