1、选择题 下列各组有机物中,只需加入溴水就能鉴别的是(?)
A.已烯、苯、四氯化碳
B.苯、已炔、已烯
C.已烷、苯、环已烷
D.甲苯、已烷、已烯
参考答案:A
本题解析:溴水使乙烯褪色,和苯分层而且溴在上层,四氯化碳和苯也分层但是溴在下层。
本题难度:简单
2、选择题 下列物质的分离方法中,是利用密度不同达到分离的是
A.把石油经蒸馏分离成为汽油,煤油和柴油等
B.煎中药时用水在煮沸条件下提取中药的有效成分
C.把大豆磨碎后,用水溶解其中的可溶性成分,经过滤后,分成豆浆和豆渣
D.做饭洗米时淘去米中的沙
参考答案:D
本题解析:A项中是利用石油中各馏分的沸点不同将其分离;B项中是利用中药某些成分的可溶性提取的;C项中利用过滤的原理将不溶性的物质与可溶于水的物质分离;D项中是利用沙的密度大将其分离除去。
本题难度:简单
3、选择题 小明体检的血液化验单中,葡萄糖为5.9×10-3mol/L。表示该体检指标的物理量是
A.溶解度(s)
B.物质的量浓度(c)
C.质量分数(w)
D.摩尔质量(M)
参考答案:B
本题解析:5.9×10-3mol/L为物质的量浓度。
本题难度:一般
4、填空题 二氧化锰可用作干电池去极剂,合成工业的催化剂和氧化剂,玻璃工业和搪瓷工业的着色剂、消色剂、脱铁剂等。
(1)二氧化锰在酸性介质中是一种强氧化剂,请用化学方程式证明:______________________。
(2)锌—锰碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。电池的总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。
①电池工作时,MnO2发生________反应。
②电池的正极反应式为________。
(3)工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
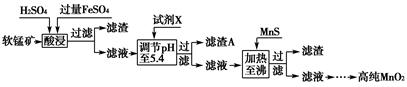
已知:软锰矿的主要成分为MnO2,还含Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物,部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表。
沉淀物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Mn(OH)2
| Cu(OH)2
|
pH
| 5.2
| 3.2
| 9.7
| 10.4
| 6.7
|
沉淀物
| Zn(OH)2
| CuS
| ZnS
| MnS
| FeS
|
pH
| 8.0
| -0.42
| 2.5
| 7
| 7
|
?
回答下列问题:
①硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为________________________。
②试剂X为________。
③滤渣A的主要成分为________。
④加入MnS的目的主要是除去溶液中的________。
参考答案:(1)MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)①还原 ②2MnO2+2e-+H2O=Mn2O3+2OH-
(3)①MnO2+2FeSO4+2H2SO4=MnSO4+
Fe2(SO4)3+2H2O
②氨水 ③Fe(OH)3和Al(OH)3 ④Cu2+、Zn2+
本题解析:(1)二氧化锰在酸性介质中是一种强氧化剂,可联想到实验室制取氯气。(2)MnO2在正极得电子,发生还原反应,电极反应式为2MnO2+2e-+H2O=Mn2O3+2OH-。(3)①根据FeSO4在反应条件下将MnO2还原为MnSO4,Fe2+被氧化为Fe3+,可以写出反应方程式:2FeSO4+MnO2+2H2SO4=MnSO4+Fe2(SO4)3+2H2O。②调节pH至5.4,是为了使Fe3+、Al3+沉淀,所选试剂为氨水。③滤渣A的主要成分为Fe(OH)3和Al(OH)3。④根据流程图可知加入MnS是为了生成CuS、ZnS而除去Cu2+、Zn2+。
本题难度:困难
5、选择题 海水晒盐的原理(?)
A.利用热蒸发浓缩海水达饱和并进一步结晶
B.通过降温降低食盐的溶解度使食盐析出
C.利用加入沉淀剂的方法是食盐沉淀析出
D.利用泥沙使海水达到饱和,然后利用日光使食盐析出
参考答案:A
本题解析:由于食盐的溶解度受温度的影响小,从食盐溶液中获得食盐主要利用蒸发溶剂的方法。故选A。
本题难度:简单